Ácido: segundo Arrhenius, são aquelas substâncias que em solução aquosa liberam cátions \({{H}_{+}}\) (hidroxônio). De forma geral, tem sabor azedo, como por exemplo limão, vinagre. Em relação aos indicadores ácido-base, faz a solução de fenolftaleína incolor, e o papel de tornassol róseo.
\[CHl\,\xrightarrow{{{H}_{2}}O}{{H}^{+}}_{(aq)}+C{{l}^{-}}_{(aq)}\]
\[CHl{{\,}_{3}}COOH \overset{{{H}_{2}}O}{\leftrightarrows}{{H}^{+}}_{(aq)}+C{{l}_{3}}CO{{O}^{-}}_{(aq)}\]
Base: segundo Arrhenius, são substâncias que em solução aquosa liberam como ânions somente os íons \({{OH}^{-}}\) (hidroxila). De forma geral, possuem sabor adstringente, como por exemplo o leite de magnésia. Em relação aos indicadores ácido-base, tornam a solução de fenolftaleína rosa e o papel de tornassol azul.
\[\begin{align} &NaOH\xrightarrow{{{H}_{2}}O}N{{a}^{+}}_{(aq)}+O{{H}^{-}}_{(aq)} \\ &N{{H}_{4}}OH\overset{{{H}_{2}}O}{\leftrightarrows}N{{H}_{4}}{{^{+}}_{(aq)}}+O{{H}^{-}}_{(aq)}\\ \end{align}\]
Dissociação e condutividade elétrica: os ácidos e bases, quando puros, como por exemplo o NaOH sólido e o HCl gasoso, não conduzem corrente elétrica. Porém, ambos, em solução aquosa, têm a propriedade de conduzir corrente elétrica. Isto ocorre devido a dissociação dessas moléculas, liberando no meio íons (cátions \({{H}^{+}}\) no caso de ácidos e ânions \({{OH}^{-}}\) no caso de bases).
\[\begin{align} &NaO{{H}_{(s)}}\to N{{a}^{+}}_{(aq)}+O{{H}^{-}}_{(aq)} \\ &HC{{l}_{(g)}}\to {{H}^{+}}_{(aq)}+C{{l}^{-}}_{(aq)} \\ \end{align}\]
A ionização é o processo no qual substâncias moleculares (eletrólitos) se dissociam em íons em solução aquosa (solução eletrolítica). O grau de dissociação (α) varia de uma substância para outra e é dado por:
α=(nº de moléculas dissociadas)/(nº de moléculas dissolvidas)x100
Se α próximo de zero, é eletrólito fraco. Já se α for próximo ou 100%, eletrólito é forte.
Para determinar a força de oxiácidos, considere o ácido genérico \({{H}_{x}}{{E}_{z}}{{O}_{y}}\), determine M=Y-X. Se m=3, ácido muito forte; m=2, ácido forte; m=1, ácido moderado e se m=0, ácido fraco.
Já para hidrácidos, em regra ácido forte: HI>HBr>HCl; ácido moderado: HF; ácido fraco: demais.
Ácidos não-oxigenados ou hidrácidos: a nomenclatura é dada por ácido nome do elementoídrico. Ex. HF ácido fluorídrico.
Ácidos oxigenados ou oxiácidos: a tabela abaixo resume em alguns exemplos a regra geral de nomenclatura
Pela dissociação dos ácidos, teremos a formação de cátions \({{H}^{+}}\) e ânions, cuja nomenclatura segue a regra:
Hidróxido de nome do elemento.
No caso de metais com cargas variáveis, deve se identificar a frente do elemento, qual a carga do cátion em algarismo romano.
É um composto covalente que tem características de base, já que em solução aquosa, libera como único ânion \({{OH}^{-}}\), por meio da reação.
\[N{{H}_{3(g)}} → {{H}_{4}}{{^{+}}_{(aq)}}+O{{H}^{-}}_{(aq)}\]
Ácido é uma substância capaz de ceder um próton a uma reação, enquanto base é capaz de receber um próton.
Ácido é a substância que numa reação química pode receber pares eletrônicos, enquanto base pode ceder pares eletrônicos.
.png)
(UEL – PR) X é uma substância gasosa nas condições ambientes. Quando liquefeita, praticamente não conduz corrente elétrica, porém forma solução aquosa que conduz bem a eletricidade. Uma fórmula possível para A é:
(UFCE - CE) Em qual das soluções, todas com mesma concentração e temperatura, a lâmpada apresenta maior brilho?
(MACKENZIE – SP) Certo informe publicitário alerta para o fato de que, se o indivíduo tem azia ou pirose com grande frequência, deve procurar um médico, pois pode estar ocorrendo refluxo gastroesofágico, isto é, o retorno do conteúdo ácido do estômago. A fórmula e o nome do ácido que, nesse caso, provoca a queimação, no estômago, a rouquidão e mesmo dor torácica são:
(ACAFE – SC) Os nomes dos ácidos oxigenados abaixo são respectivamente:
\[HN{{O}_{2}}\,\,\,\,\,\,HCl{{O}_{3}}\,\,\,\,\,\,{{H}_{2}}S{{O}_{3}}\,\,\,\,\,\,{{H}_{3}}P{{O}_{4}}\]
(UFSM – RS) Associe a \({{2}^{a}}\) coluna à \({{1}^{a}}\), considerando os ácidos.
A sequência das combinações corretas é:
(UFGO – GO) O \(Mg{{(OH)}_{2}}\) em água (leite de magnésia) é consumido popularmente como laxante e antiácido. De acordo com a equação abaixo, pede-se apontar as afirmativas corretas sobre o \(Mg{{(OH)}_{2}}\).
(UFPA - PA) Entre as bases dadas a seguir, indique quais são praticamente insolúveis em água.
I. KOH.
II. \(Mg{{(OH)}_{2}}\).
III. NaOH.
IV. \(Al{{(OH)}_{3}}\).
V. \(Fe{{(OH)}_{2}}\).
VI. LiOH.
(UFSM – RS) Sabe-se que a reação de formação do hidróxido de amônio do detergente, que contém amoníaco, é expressa pela equação:
\[N{{H}_{3}}+{{H}_{2}}O\,\to \,N{{H}_{4}}^{+}+O{{H}^{-}}\]
Fazemos, então, as seguintes afirmativas:
I - O produto dessa reação se encontra altamente dissociado.
II - A solução tem pH básico.
III - De acordo com a teoria de Arrhenius, bases são substâncias que se dissociam em água, produzindo íons \({{OH}^{-}}\).
(FEI – SP) Num recipiente contendo uma substância A, foram adicionadas gotas de fenolftaleína, dando uma coloração rósea. Adicionando-se uma substância B em A, a solução apresenta-se incolor. Com base nessas informações, podemos afirmar que:
(FUVEST – SP) Nas condições ambientes, pastilhas de hidróxido de sódio, expostas ao ar durante várias horas, transformam-se em um líquido claro. Este fenômeno ocorre porque o hidróxido de sódio:
(UFAL – AL) Qual das equações abaixo relacionadas representa um processo em que o produto formado é bom condutor de eletricidade?
(MACKENZIE – SP) Dentre as fórmulas dadas, a única que representa um ácido de Arrhenius é:
(UFRGS) Considera a reação abaixo.
Assinale a alternativa que preenche corretamente as lacunas do enunciado abaixo, na ordem em que aparecem.
O composto BF3 apresenta uma geometria ______ e atua como _____ ao reagir com água.
(FEI – SP) Considerando os compostos \({{H}_{3}}P{{O}_{2}}\), \({{HNO}_{3}}\) e HCN, podemos afirmar que são, respectivamente, ácidos:
(FATEC – SP) Considerando os ácidos \({{HNO}_{3}}\) (ácido nítrico), \({{H}_{2}}S{{O}_{3}}\) (ácido sulfuroso) e \({{HClO}_{4}}\) (ácido perclórico), a ordem crescente de força é:
(UEPI) Sejam os seguintes ácidos, com seus respectivos graus de ionização (α): \(HCl{{O}_{4}}\) (α = 97%); \({{H}_{2}}S{{O}_{4}}\) (α = 61 %); \({{H}_{3}}B{{O}_{3}}\) (α = 0,025%); \({{H}_{3}}P{{O}_{4}}\) (α = 27%); \(HN{{O}_{3}}\) (α = 92%). Assinale a afirmativa correta.
(CESGRANRIO) A respeito de alguns ácidos comercialmente utilizados na indústria, são feitas as afirmativas a seguir.
I. O ácido bromídrico é mais forte que o ácido fluorídrico em solução aquosa.
II. O ácido sulfúrico pode ser obtido pela reação do anidrido sulfúrico com água.
III. O ácido clorídrico reage com óxido de sódio formando cloreto de sódio e água.
IV. O ácido nítrico reage com cobre e mercúrio e não reage com ouro. São corretas as afirmativas.
São corretas as afirmativas:
(UFSM – RS) Analise as seguintes afirmativas:
I. \(HCl{{O}_{3}}\) possui duas ligações covalentes normais e duas ligações dativas.
II. \({{H}_{3}}P{{O}_{3}}\) apresenta apenas ligações covalentes simples.
III. \({{H}_{2}}S{{O}_{4}}\) possui seis ligações covalentes normais e uma ligação dativa.
Está(ão) correta(s)
(MACKENZIE – SP) Os ácidos identificados pelas fórmulas \(HCl{{O}_{4}}\)(aq), \(HCl{{O}_{2}}\)(aq.), HClO(aq.) e \(HCl{{O}_{3}}\)(aq.) denominam-se, respectivamente:
(FUVEST – SP) Assinale a alternativa que apresenta dois produtos caseiros com propriedades alcalinas:
(MACKENZIE – SP) Na reação entre os gases \({{N}_{2}}\) e \({{H}_{2}}\), obtém-se unicamente gás amônia. A solução aquosa de amônia recebe o nome de amoníaco (hidróxido de amônio), que é componente ativo de produtos de limpeza usados para remoção de gorduras. A partir dessas informações, considere as seguintes afirmações:
I. O hidróxido de amônio tem fórmula \({{NH}_{3}}\).
II. Na formação do gás amônia, a reação ocorrida é de síntese.
III. O amoníaco tem fórmula \(N{{H}_{4}}OH\).
IV. A amônia tem fórmula \(N{{H}_{4}}OH\).
V. O cheiro irritante e forte que se sente quando se usa amoníaco é proveniente do gás nitrogênio.
Estão corretas somente:
(UEM - PR) Assinale o que for correto.
(UEM – PR) Assinale o que for correto.
(UEM – PR) Considere a reação a seguir e assinale o que for correto.
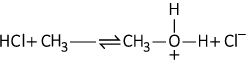
Dados: HCl (pKa = -7); \(C{{H}_{3}}O{{H}_{2}}^{+}\) (pKa = 16)
(UECE – CE) Considere os seguintes ácidos, com seus respectivos graus de ionização (a 18 °C) e usos:
• \({{H}_{3}}P{{O}_{4}}\) (α = 27 %), usado na preparação de fertilizantes e como acidulante em bebidas refrigerantes
• \({{H}_{2}}S\) (α = 7,6 x 10-2 %), usado como redutor
• \(HCl{{O}_{4}}\) (α = 97 %), usado na medicina, em análises químicas e como catalisador em explosivos
• HCN (α = 8,0 x 10-3 %), usado na fabricação de plásticos, corantes e fumigantes para orquídeas e poda de árvores.
Podemos afirmar que:
(FAB) A metilamina e a etilamina são duas substâncias gasosas à temperatura ambiente que apresentam forte odor, geralmente caracterizado como de peixe podre. Uma empresa pretende evitar a dispersão desses gases e para isso adaptou um sistema de borbulhamento do gás residual do processamento de carne de peixe em uma solução aquosa.
Um soluto adequado para neutralizar o odor da metilamina e etilamina é
(UNESP - SP) Escreva:
(FUVEST – SP)
(VUNESP) Verifica-se experimentalmente que tanto a água quanto o ácido nítrico puro são maus condutores de eletricidade. Observa-se, também, que uma solução de ácido nítrico em água é boa condutora de eletricidade. Explique essas observações experimentais.
(FEI – SP) Por que o gás amoníaco \((N{{H}_{3}})\), quando liquefeito, não conduz corrente elétrica e o faz quando em solução aquosa?
Você chegou ao fim dessa aula com sucesso!
Selecione o botão avançar para seguir para a próxima aula.