Cálculos estequiométricos são métodos utilizados para conhecermos as quantidades de reagentes que serão utilizados em uma reação, assim como dos produtos obtidos, considerando reagentes em excesso, pureza dos reagentes etc. Essas quantidades de reagentes e produtos podem ser consideradas em diversas formas: massa, volume, quantidade em mols, número de moléculas, concentrações, e a partir destas, convertendo uma a outra, podemos fazer os cálculos necessários.
Tais cálculos devem ser pautados na Lei de Proust, ou seja, na proporcionalidade entre as massas de reagentes e produtos das reações químicas e na composição fixa das substâncias puras.
É importante lembrar que a base para o cálculo estequiométrico são as relações molares. Sendo assim, convém recordarmos que

Para facilitar a compreensão dos cálculos estequiométricos necessários, podemos seguir algumas regras:
Exemplos: Considere a reação química \(2\,C{{O}_{(g)}}+1\,{{O}_{2(g)\,}}\to \,2\,C{{O}_{2}}\).
a) Massa-Volume: Determine o volume de gás carbônico gerado, nas CNTP, na reação de 16 g de oxigênio com monóxido de carbono.
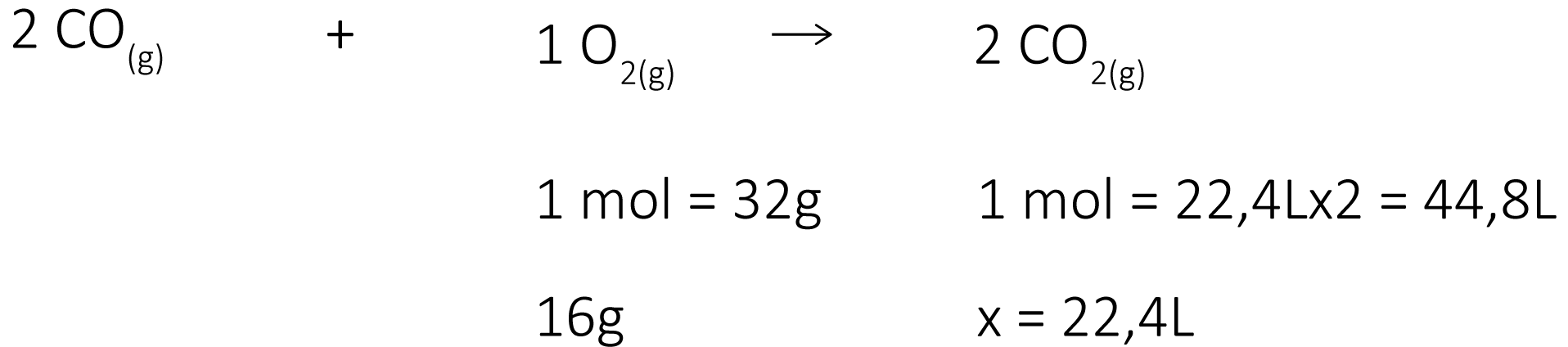
b) Mol-Volume: Para obtermos 4,48L de gás carbônico, nas CNTP, quantos mols de monóxido de carbono são necessários?
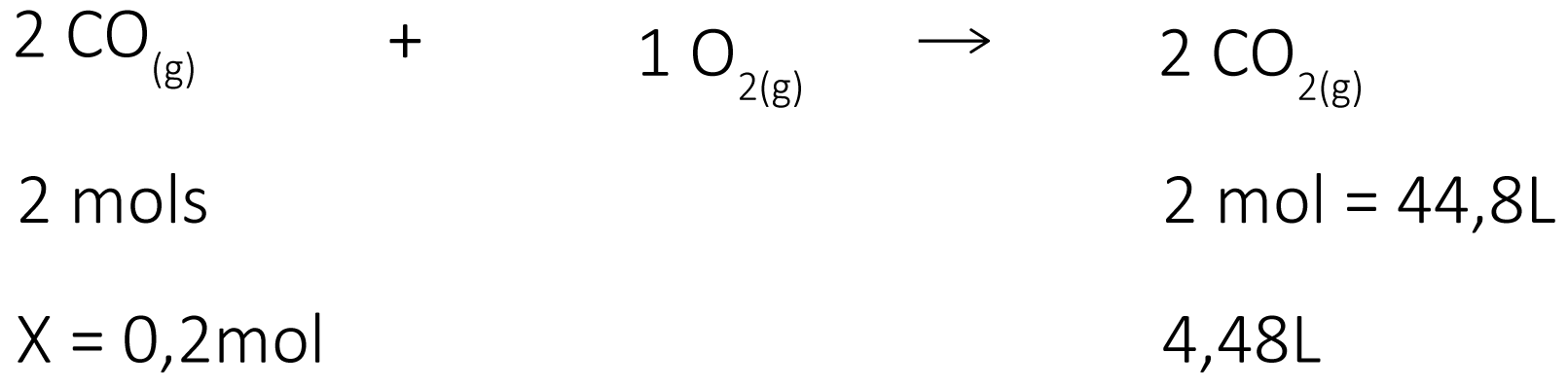
c) Massa-Mol: Qual a massa de oxigênio necessária para se obter 5 mols de gás carbônico?
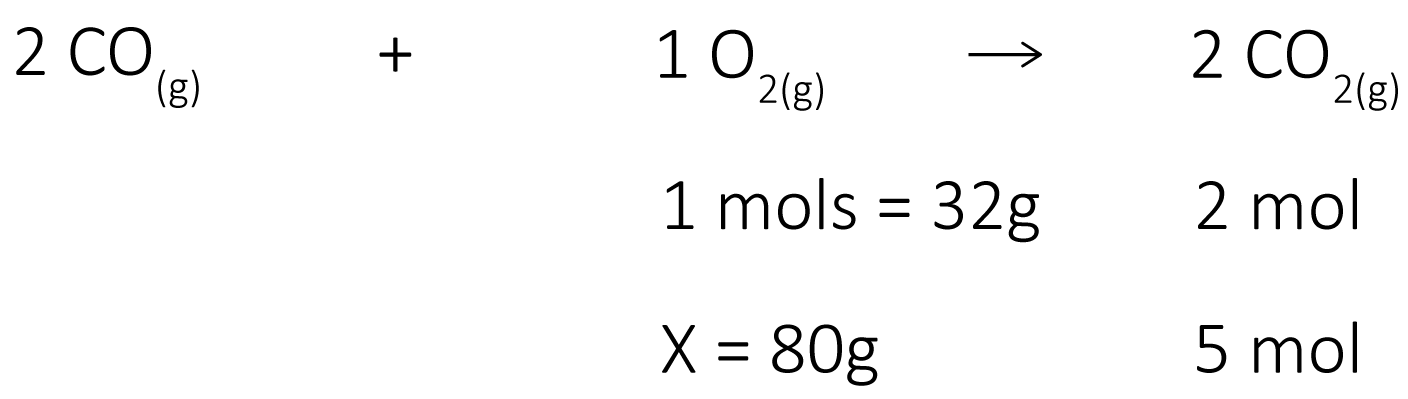
d) Reagentes em excesso: São levados a um sistema reacional 112 g de monóxido de carbono e 50g de oxigênio. Determine se todos os reagentes serão consumidos por completo ou se haverá excesso.
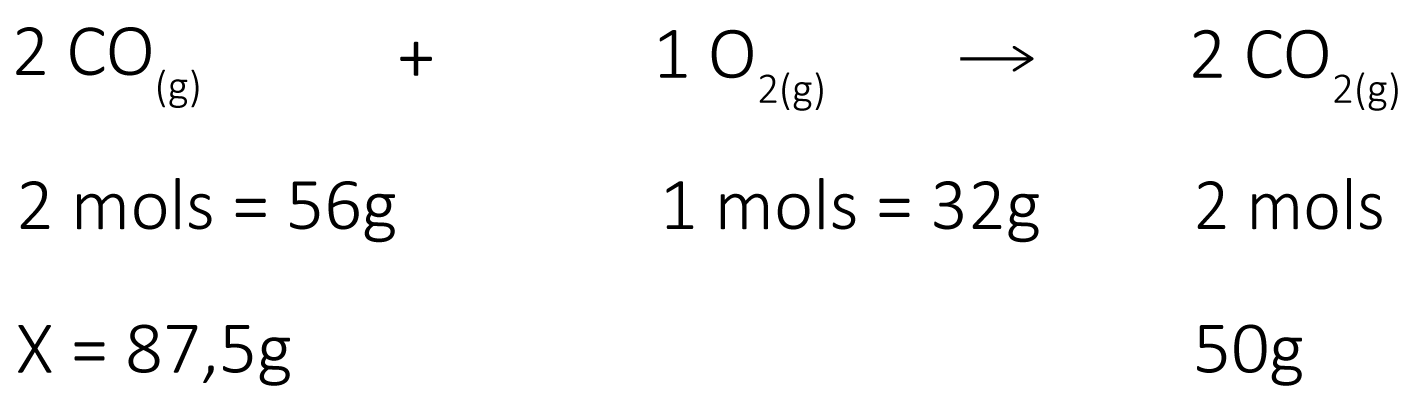
Como no sistema havia 112 g de monóxido de carbono, porém, só 87,5g serão consumidos, haverá um excesso de 24,5 g de CO.
Exemplo: Considere a reação de neutralização de 18,25 g de ácido clorídrico com 22 g de hidróxido de sódio contendo impurezas. Determine o grau de pureza do hidróxido de sódio.
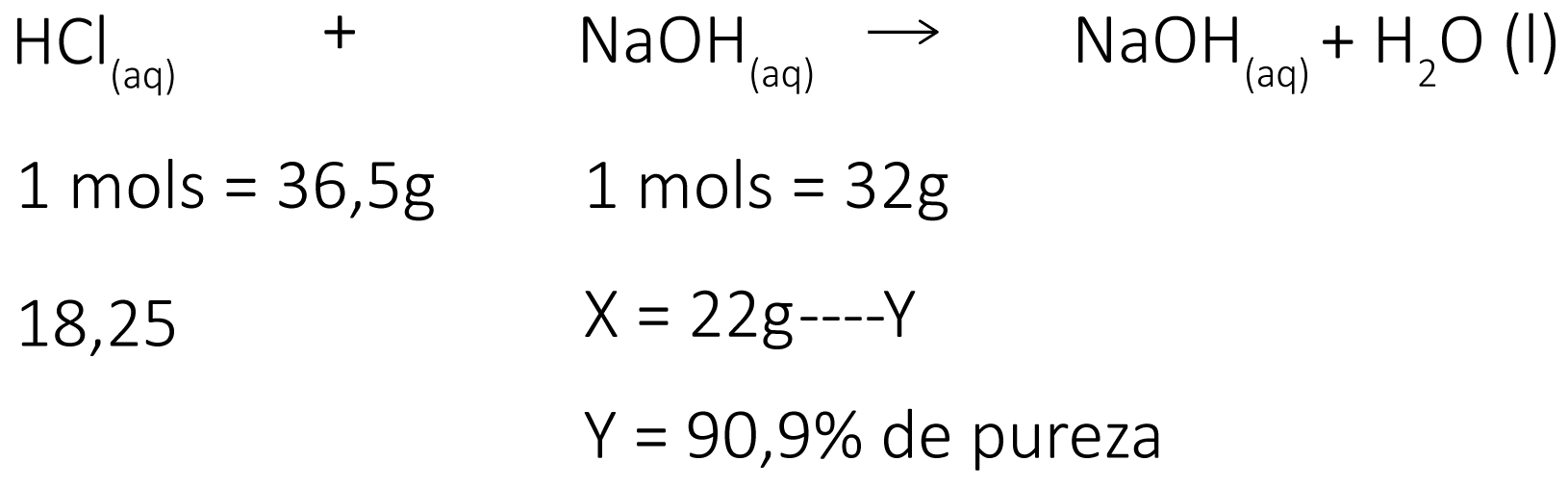
(ENEM) Atualmente, sistemas de purificação de emissões poluidoras estão sendo exigidos por lei em um número cada vez maior de países. O controle das emissões de dióxido de enxofre gasoso, provenientes da queima de carvão que contém enxofre, pode ser feito pela reação desse gás com uma suspensão de hidróxido de cálcio em água, sendo formado um produto não poluidor do ar. A queima do enxofre e a reação do dióxido de enxofre com o hidróxido de cálcio, bem como as massas de algumas das substâncias envolvidas nessas reações, podem ser assim representadas:
enxofre (32 g) + oxigênio (32 g) → dióxido de enxofre (64 g);
dióxido de enxofre (64 g) + hidróxido de cálcio (74 g) → produto não poluidor.
Dessa forma, para absorver todo o dióxido de enxofre produzido pela queima de uma tonelada de carvão (contendo 1% de enxofre), é suficiente a utilização de uma massa de hidróxido de cálcio de, aproximadamente:
(UEL - PR) Provoca-se reação da mistura formada por 10,0 g de hidrogênio e 500 g de cloro. Após a reação, constata-se a presença de 145 g de cloro remanescente, junto com o produto obtido. A massa, em gramas, da substância formada é:
(MACKENZIE - SP) Adicionando-se 4,5 g de gás hidrogênio a 31,5 g de gás nitrogênio originam-se 25,5 g de amônia, sobrando ainda nitrogênio que não reagiu. Para se obterem 85 g de amônia, a quantidade de hidrogênio e de nitrogênio necessária é, respectivamente:
(UNIPA) Uma indústria queima diariamente 1.200 kg de carvão (carbono) com 90% de pureza. Supondo que a queima fosse completa, o volume de oxigênio consumido para essa queima nas CNTP seria de:
(Dados: C = 12 ; volume molar nas CNTP = 22,4 L/mol)
(IFCE - CE) Observando a reação entre o óxido nítrico (NO) e o gás oxigênio \(2NO\,+\,{{O}_{2}}\, \to \,2N{{O}_{2}}\), é correto afirmar-se que
(MACKENZIE - SP) Uma amostra de 340,0 g de salitre do Chile, cujo teor em nitrato de sódio é de 75%, reage com ácido sulfúrico concentrado, produzindo bissulfato de sódio (\(NaHS{{O}_{4}}\)) e ácido nítrico. A massa mínima de ácido, necessária para reagir com todo o nitrato de sódio, é igual:
Dadas as massas molares (g/mol): H = 1, N = 14, O = 16, Na = 23 e S = 32
(VUNESP) Considere a reação em fase gasosa:
\[{{N}_{2}}+3\,{{H}_{2\,}}\to\,2\,N{{H}_{3}}\]
Fazendo-se reagir 4 litros de \({{N}_{2}}\) com 9 litros de \({{H}_{2}}\) em condições de pressão e temperatura constantes, pode-se afirmar que:
(VUNESP) São colocadas para reagir entre si as massas de 1,00 g de sódio metálico e 1,00 g de cloro gasoso. Considere que o rendimento da reação é 100%. São dadas as massas molares, em g/mol: Na = 23,0 e Cl = 35,5. A afirmação correta é:
(CESGRANRIO - RJ) A reação entre 28 g de ferro e 64 g de enxofre fornece uma quantidade de sulfeto ferroso igual a:
1 Fe + 1 S → 1 FeS
(Dados: S = 32 ; Fe = 56.)
(UFU) O sal de cozinha pode ser produzido pela reação entre o sódio metálico e o cloro gasoso. Supondo que o rendimento da reação seja de 80% e que partamos de 7,60 g de sódio metálico e 7,60 g de cloro gasoso, é incorreto afirmar que:
Dados: Na = 23; Cl = 35,5.
(UEL – PR) 46,0 g de sódio reagem com 32,0 g de oxigênio formando peróxido de sódio. Quantos gramas de sódio são necessários para se obter 156 g de peróxido de sódio?
(UFSC - SC) Foi somente no século XIX que a Química passou a ter o caráter de ciência. Quem muito contribuiu para isso foi o químico francês Antoine Laurent de Lavoisier (1743-1794), que em seus trabalhos passou a utilizar regularmente a balança.
Assinale a(s) proposição(ões) verdadeira(s), de acordo com as constatações de Lavoisier ao utilizar este instrumento:
(UFPE - PE) Um pedaço de ferro pesando 5,60 gramas sofreu corrosão quando exposto ao ar úmido por um período prolongado. A camada de ferrugem formada foi removida e pesada, tendo sido encontrado o valor de 1,60 grama. Sabendo-se que a ferrugem tem a composição \(F{{e}_{2}}{{O}_{3}}\), quantos gramas de ferro não corroído ainda restaram?
Considere Fe = 56,0 g/ mol e \(F{{e}_{2}}{{O}_{3}}\) = 160,0 g/mol. a) 2,40 g
(UNIFESP) \(Si{{H}_{4}}\) e \(S{{i}_{2}}{{H}_{6}}\), gases em condições ambientais, se comportam da mesma forma que os hidrocarbonetos de fórmula análoga, em suas reações de combustão total. 2,0 litros de uma mistura equimolar desses gases, medidos em condições ambientais, foram submetidos a uma combustão total. Qual o volume de \({{O}_{2}}\) nas mesmas condições, consumido nesta combustão?
(UEM - PR) A dissolução de um medicamento antiácido que contém 1,92 g de bicarbonato de sódio (\(NaHC{{O}_{3}}\)) e 1,92 g de ácido cítrico (\({{C}_{6}}{{H}_{8}}{{O}_{7}}\)) provoca efervescência, conforme a seguinte reação:
\(3NaHC{{O}_{3}}+{{C}_{6}}{{H}_{8}}{{O}_{7}}\,\to\,3C{{O}_{2}}+3{{H}_{2}}O+N{{a}_{3}}{{C}_{6}}H_{5}{{O}_{7}}\)
Sobre esse processo, é correto afirmar que
(UEM - PR) Considerando a reação abaixo, em que o coeficiente estequiométrico “x” é uma incógnita, assinale o que for correto.
\[Al{{(OH)}_{3(aq)}}+{3}/{2}\;{{H}_{2}}S{{O}_{4(aq)}}\,\to\,{1}/{2}\;A{{l}_{2}}{{(S{{O}_{4}})}_{3}}+x\,{{H}_{2}}{{O}_{(l)}}\]
(UEM - PR) Um novo diesel lançado recentemente foi chamado de S50, pois contém somente 50 ppm de enxofre em sua composição. Com base nessa informação, assinale a(s) alternativa(s) correta(s).
(UEPG - PR) Considere a seguinte reação balanceada em fase gasosa, \(1\,{{N}_{2}}(g)+3{{H}_{2}}(g)\,\to\,2N{{H}_{3}}(g)\).
De acordo com essa reação, assinale o que for correto. Dados:
(PUC – SP) Considerando-se a reação representada abaixo, que ocorre em um ambiente fechado e sob aquecimento, e os dados Fe=56 e S=32, assinale o que for correto.
\[F{{e}_{(s)}}+{{S}_{(s)}}\,\to\,Fe{{S}_{(s)}}\]
(UEM - PR) Quantas toneladas de óxido de cálcio (CaO) serão produzidas através da decomposição de 100 toneladas de carbonato de cálcio com 90% de pureza?
(UEM - PR) Considerando a reação \(2Cu+{{O}_{2}}\,\to \,2CuO\), assinale a alternativa incorreta.
(Dados: Cu = 63; O = 16).
(ITA - SP) Certa massa de nitrato de cobre \((Cu{{(N{{O}_{3}})}_{2}})\) foi calcinada em ambiente aberto até restar um resíduo com massa constante que é sólido e preto. Formaram-se dois produtos gasosos, conforme a equação química: \(2Cu{{(N{{O}_{3}})}_{2}}\,\to\,2Cu{{O}_{(s)}}+4N{{O}_{2(g)}}+{{O}_{2(g)}}\). A massa do NO2 formado na reação de decomposição é igual a 18,4 g. Qual é o valor que mais se aproxima da massa inicial do nitrato de cobre?
(ITA - SP) Num recipiente inerte, hermeticamente fechado, existem disponíveis 100g de ferro, 100 g de água e 100g de oxigênio. Supondo que ocorra a reação representada por:
\[2Fe+3{{H}_{2}}O+{3}/{2{{O}_{2}}}\;\,\to\,2NH{{(OH)}_{3}}\]
e que a reação prossiga até o consumo completo do(s) reagente(s) minoritário(s), podemos prever que irá(irão) sobrar:
(UEMG) O ferro metálico, em contato com o gás oxigênio, durante alguns meses, sofre oxidação chegando a um tipo de ferrugem denominado óxido férrico. Quantos mols de ferro metálico são oxidados por 134,4 litros de gás oxigênio, medido nas CNTP?
(FURG) A decomposição térmica do nitrato cúprico é representada pela seguinte equação:
\[2Cu{{(N{{O}_{3}})}_{2}}\,\to\,2Cu{{O}_{(s)}}+4N{{O}_{2(g)}}+{{O}_{2(g)}}\]
Calcule a massa de óxido cúprico que se obtém a partir da decomposição de 500 g de nitrato cúprico, sabendo-se que este apresenta 75% de pureza em \(Cu{{(N{{O}_{3}})}_{2}}\).
Dados: massas atômicas → N = 14 ; O = 16; Cu = 64.
(PUC) O anidrido sulfuroso (\({{O}_{2}}\)) reage com oxigênio (\({{O}_{2}}\)) e água (\({{H}_{2}}O\)) para formar \({{H}_{2}}S{{O}_{4}}\). Admitamos que usemos 6,4 toneladas de \({{O}_{2}}\) por dia, com uma eficiência de conversão de 70%. Qual a produção de \({{H}_{2}}S{{O}_{4}}\) ao cabo de 10 dias? Dados: H = 1 ; O = 16 ; S = 32
(FUVEST - SP) Duas das reações que ocorrem na produção do ferro são representadas por:
\[\begin{align} & 2{{C}_{(g)}}+{{O}_{2}}_{(g)}\to\,2C{{O}_{(g)}} \\ &F{{e}_{2}}{{O}_{3}}(g)+3CO(g)\,\to \,2Fe(g)+3C{{O}_{2}}(g) \\ \end{align}\]
O monóxido de carbono formado na primeira reação é consumido na segunda. Considerando apenas essas duas etapas do processo, calcule a massa aproximada, em quilogramas, de carvão consumido na produção de 1 t de ferro.
Dados: massas atômicas → Fe = 56 ; C = 12 ; O = 16
(FUVEST - SP) A transformação química:
\(\begin{align} &Kl(s)\,\,\,+\,\,\,\,Pb(NO3)2(s)\,\,\,\to \,\,\,2KNO3(s)\,\,\,+\,\,\,Pb2(s)\\ &(branco)\,\,\,\,\,\,\,\,\,\,\,\,\,(branco)\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,(branco)\,\,\,\,\,\,\,\,\,\,\,(amarelo)\\ \end{align}\)
é um exemplo de reação entre sólidos, que ocorre rapidamente. Em um recipiente de vidro com tampa, de massa igual a 20 g, foram colocados 2 g de KI e 4 g de \(Pb{{(N{{O}_{3}})}_{2}}\), pulverizados. O recipiente, hermeticamente fechado, foi vigorosamente agitado para ocorrer a reação.
(VUNESP) Duas amostras de carbono puro de massa 1,00 g e 9,00 g foram completamente queimadas ao ar. O único produto formado nos dois casos, o dióxido de carbono gasoso, foi totalmente recolhido e as massas obtidas foram 3,66 g e 32,94 g, respectivamente. Utilizando estes dados:
(VUNESP) Aquecendo-se 21 g de ferro com 15 g de enxofre obtém-se 33 g de sulfeto ferroso, restando 3 g de enxofre. Aquecendo-se 30 g de ferro com 16 g de enxofre obtém-se 44 g de sulfeto ferroso, e restando 2 g de ferro. Demonstre que esses dados obedecem às leis de Lavoisier (conservação da massa) e de Proust (proporções definidas).
Você chegou ao fim dessa aula com sucesso!
Selecione o botão avançar para seguir para a próxima aula.