Elemento químico: conjunto de átomos que possuem características semelhantes.
Substâncias puras: Qualquer tipo de matéria com composição química e propriedades físicas e químicas constantes, ou seja, são um conjunto de moléculas quimicamente iguais. Podem ser de dois tipos, substâncias puras simples ou compostas.
Conjunto de matéria com moléculas iguais, que apresentam um único elemento químico. Por exemplo: \(O_2\), \(N_2\), \(CI_2\), \(He\).
Vale lembrar que átomos de um mesmo elemento químico podem formar substâncias puras simples distintas, com propriedades físicas e químicas diferentes (alotropia), como o caso do gás oxigênio \((O_2)\) e ozônio \((O_3)\) e carbono na forma de grafite e diamante.
Conjunto de matéria com moléculas iguais, que apresentam mais de um tipo de elemento na molécula. Por exemplo: \(H_2 O\), \(CO_2\), \(H_2SO_4\).
Propriedades físicas da matéria: as substâncias puras simples ou compostas apresentam propriedades físicas constantes, como ponto de fusão, ponto de ebulição e densidade.
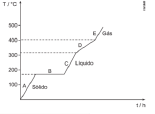
É a temperatura constante na qual um sólido se transforma em líquido. Nesta temperatura constante, o sólido começa a se liquefazer, e o sistema se mantém nessa temperatura até que todo o sólido tenha se transformado em líquido. Ponto de fusão e solidificação ocorrem à mesma temperatura.
É a temperatura constante na qual um líquido passa para o estado gasoso. Ao atingir tal temperatura, o líquido começa a se transformar em gás, e o sistema se mantém em temperatura constante até que todo o sistema se encontre no estado gasoso. Ponto de ebulição e condensação ocorrem à mesma temperatura.
.png)
O processo de passagem do estado líquido para gasoso pode ser também chamado de calefação (quando ocorre a transformação de forma abrupta, como aproximando a água de uma superfície muito quente), ou evaporação, que é a transformação de água líquida em gasosa de forma lenta, a temperatura ambiente.
Alguns materiais, como a naftalina, apresentam a transformação do estado sólido para gasoso, sem passar pelo estado líquido. Este processo se nomeia sublimação.
No caso de substâncias que não são puras, ou seja, misturas, os pontos de fusão e ebulição não são constantes, ou seja, as transformações ocorrem em um dado intervalo de temperatura.
.png)
Conhecendo-se as temperaturas de fusão e ebulição de determinada substância, podemos determinar qual o estado físico desse material em uma dada temperatura, por meio do esquema abaixo. Se T < PF, a substância é sólida. Se PF < T< PE, a substância é líquida. Se T > PE, a substância é gasosa.
Densidade: é a razão entre massa e volume de determinada substância pura. É dada pela equação:
\[densidade(g/{{m}^{3}})=\frac{massa(g)}{volume(c{{m}^{3}})}\]
As misturas podem ser homogêneas (também chamadas de soluções), quando são constituídas por uma só fase. Ex. água e sal; ar atmosférico, ouro 18 quilates (75% de ouro e 25% de cobre) ou heterogêneas, quando contêm duas ou mais fases (ex. água e óleo, areia e sal).
Um sistema composto por água líquida e cubos de gelo caracteriza-se como heterogêneo, pois é descontínuo, porém, é formado por uma única substância, água, portanto, é uma substância pura.
Existem misturas que, durante uma das mudanças de estado, apresentam comportamento de substâncias puras, conhecidas como misturas eutéticas e azeotrópicas.
Mistura eutética é aquela que apresenta temperatura constante durante a fusão. Ex. Liga metálica utilizada na solda, composta por 37% de chumbo 63% de estanho.
Mistura azeotrópica é aquela que apresenta temperatura constante durante a ebulição. Ex. álcool etílico e água; acetona e metanol; álcool etílico e clorofórmio.
(UFJF – PISM) A solda macia (ou solda branca) é uma solda comum à base de uma liga de estanho e chumbo em variadas proporções. Na eletroeletrônica, as soldas são mais usadas em forma de fios, com a liga estanho/chumbo de proporção 60/40, a qual possui ponto de fusão igual a 183 °C. Analisando o gráfico abaixo, que mostra o comportamento térmico dessa solda, assinale a afirmativa CORRETA:
(OSEC - SP) Em qual das sequências abaixo estão representados um elemento, uma substância simples e uma substância composta, respectivamente:
(MACKENZIE - SP) O número de substâncias simples com atomicidade par entre as substâncias \(O_2\), \(H_2O_2\), \(P_4\), \(I_2\), \(C_2O4\), \(CO_2\) e He é:
(UFMG - MG) Uma amostra de uma substância X teve algumas de suas propriedades determinadas. Todas as alternativas apresentam propriedades que são úteis para identificar essa substância, exceto:
(UFAC - AC) Com relação às substâncias \(O_2\), \(H_2\), \({{H}_{2}}0\), Pb, \(CO_2\), \(O_3\), \(CaO\) e \(S_8\), podemos afirmar que:
(IFSC - SC) A matéria pode se apresentar, basicamente, em três estados físicos: sólido, líquido e gasoso. Sabemos que a matéria pode mudar de estado, dependendo do fornecimento ou retirada de energia.
Assinale a alternativa CORRETA. Quando uma substância está no estado líquido e muda para o gasoso, dizemos que ela sofreu
(UPF) No quadro a seguir, estão apresentadas as temperaturas de fusão e de ebulição, em °C, sob pressão de 1atm, de diferentes substâncias químicas.
Com base nas informações constantes no quadro, analise as afirmações a seguir e marque V para verdadeiro e F para falso.
(____) As substâncias metanol e mercúrio, à temperatura de 60 C, ° estarão no estado líquido de agregação.
(____) As interações que mantêm unidas, no estado sólido, as moléculas das substâncias amônia, metanol e acetona são forças do tipo dipolo induzido, as quais formam cristais moleculares.
(____) Entre as substâncias listadas, o cloreto de sódio apresenta a maior temperatura de fusão, o que se justifica em razão de seus íons estarem unidos por interações do tipo dipolo permanente, formando retículos cristalinos iônicos.
(____) O modelo para a formação do Al, no estado sólido, se baseia na interação entre os cátions do metal que se agrupam, formando células unitárias em que as cargas positivas são estabilizadas por elétrons semilivres, que envolvem a estrutura como uma nuvem eletrônica
(____) O gás oxigênio \(O_2\)(g) apresenta os menores valores de temperaturas de fusão e de ebulição, pois suas moléculas se mantêm unidas por forças de dipolo induzido, que são de fraca intensidade.
A sequência correta de preenchimento dos parênteses, de cima para baixo, é:
(PUC - MG) Numere a segunda coluna de acordo com a primeira.
Assinale a sequência CORRETA encontrada.
(UFPR - PR) O mercúrio é um metal que possui densidade de 13,6 g/cm³ em condições normais. Dessa forma, um volume de 1 litro (1 dm³) desse metal tem massa, em quilogramas, igual a:
(CEFET) Durante uma aula prática, um professor solicita a um aluno que investigue qual a composição química de um determinado objeto metálico. Para isso, ele
Nessa situação, o aluno concluiu, corretamente, que o objeto é constituído de
(UNIFOR - CE) - Dois líquidos, A e B, quimicamente inertes, e não-miscíveis entre si, de densidades \(d_A\) = 2,80g/cm³ e \(d_B\) = 1,60g/cm³, respectivamente, são colocados em um mesmo recipiente. Sabendo que o volume do líquido A é o dobro do de B, a densidade da mistura, em g/cm³, vale:
(FMU - SP) - Um vidro contém 200 cm³ de mercúrio de densidade 13,6 g/cm³. A massa de mercúrio contido no vidro é:
(ENEM) Um consumidor desconfia que a balança do supermercado não está aferindo corretamente a massa dos produtos. Ao chegar à casa resolve conferir se a balança estava descalibrada. Para isso, utiliza um recipiente provido de escala volumétrica contendo 1,0 litro d’água. Ele coloca uma porção dos legumes que comprou dentro do recipiente e observa que a água atinge a marca de 1,5 litro e também que a porção não ficara totalmente submersa, 1/3 de seu volume fora d’água. Para concluir o teste, o consumidor, com ajuda da internet, verifica que a densidade dos legumes, em questão, é a metade da densidade da água, onde, ρ água = 1 g/cm³. No supermercado a balança registrou a massa da porção de legumes igual a 0,500 kg (meio quilograma). Considerando que o método adotado tenha boa precisão, o consumidor concluiu que a balança estava descalibrada e deveria ter registrado a massa da porção de legumes igual a
(FACIMPA – MG) - Observe:
I – Uma pedra de naftalina deixada no armário;
II – Uma vasilha de água deixada no freezer;
III- Uma vasilha de água deixada no fogo;
IV – O derretimento de um pedaço de chumbo quando aquecido;
Nesses fatos estão relacionados corretamente os seguintes fenômenos:
Escolha uma:
(UNISC) Observando uma lata de cerveja esquecida no freezer, podemos definir o fenômeno de mudança de estado como sendo a
(UNIFOR - CE) - Uma substância no estado líquido é resfriada uniforme e constantemente. Ao atingir a temperatura de solidificação, verifica-se a formação de pequenas partículas sólidas que flutuam no líquido. Sobre essa substância é correto afirmar que:
(FAEE - GO) Na ebulição da água, verifica-se o desprendimento de bolhas de:
(UFRJ - RJ) - Podemos classificar, como processos endotérmico e exotérmico, respectivamente, as mudanças de estado:
(PUC - MG) - Numa praia, em pleno verão, um estudante de Química observou que o carrinho de picolé usava “gelo-seco” para retardar o degelo dos picolés. Pediu à vendedora um pedaço de gelo e colocou-o num copo com água, ocorrendo formação de “fumaças brancas”. Observou-se então o fenômeno de:
(UEM - PR) Considerando as temperaturas de fusão e de ebulição (em “ºC”) das substâncias mostradas na tabela abaixo, assinale o que for correto.
(UEM - PR) Considerando que as matérias descritas na tabela abaixo estão em um ambiente a 25 ºC, assinale o que for correto.
(UEFS) Considere uma amostra sólida que apresenta ponto de fusão constante e coloração amarela uniforme. Dissolve somente parte do sólido com adição de água e após fundir totalmente, com aquecimento contínuo, entra em ebulição com temperatura variável.
Com base nessa informação, é correto afirmar que essa amostra
(UEM - PR) Assinale a(s) alternativa(s) correta(s).
(UEL - PR) Um rapaz pediu sua namorada em casamento presenteando-a com uma aliança de ouro 18 quilates. Para comemorar, sabendo que o álcool é prejudicial à saúde, eles brindaram com água gaseificada com gelo, ao ar livre. Os sistemas: ouro 18 quilates, água gaseificada com gelo e ar atmosférico, são, respectivamente:
(UEM - PR) Assinale o que for correto.
(UFTM - MG) Uma amostra de um sólido branco foi colocada em um tubo de ensaio e durante seu aquecimento observou-se a formação de um líquido. A seguir, o tubo foi colocado em um recipiente com água e gelo, e novamente aquecido até o tubo ficar vazio. A temperatura da amostra foi medida em intervalos de tempos iguais, e os dados obtidos, foram utilizados para construir o diagrama a seguir:
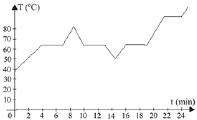
Pelo estudo do diagrama, pode-se afirmar que ele representa as curvas de aquecimento e resfriamento de uma
(UFPA) Observe os frascos I, II e III e seus conteúdos indicados abaixo:

Juntando-se sob agitação os conteúdos desses três frascos, de modo que o açúcar e o cloreto de sódio sejam totalmente solubilizados e que ainda restem alguns cubos de gelo, resultará um sistema heterogêneo:
(FUVEST - SP) Bronze, “Gelo seco” e Diamante são, respectivamente, exemplos de:
(UEM - PR) A tabela abaixo representa o processo no qual uma amostra sólida (a 20 ºC) desconhecida recebe um fluxo de calor constante e se aquece.
De acordo com os dados da tabela, é correto afirmar que
(UEG - GO) Em um laboratório de química, um estudante separou em frascos semelhantes três solventes que utilizaria em seu experimento. Entretanto, esqueceu de rotular esses frascos no momento da coleta e, posteriormente, não tinha certeza a respeito do componente de cada um deles. Mas, conhecendo a densidade de cada um dos líquidos, para sanar sua dúvida, efetuou o seguinte experimento. Adicionou 3 mL de cada solvente em tubos de ensaios separados e posteriormente adicionou 1 mL de água. A análise dos resultados permitiu a identificação inequívoca dos componentes presentes em cada frasco. Os resultados observados para cada tubo de ensaio e a tabela com as respectivas densidades dos líquidos estão mostrados na figura e na tabela abaixo:

A partir das informações acima, responda ao que se pede.
Você chegou ao fim dessa aula com sucesso!
Selecione o botão avançar para seguir para a próxima aula.