Consideremos uma reação reversível genérica
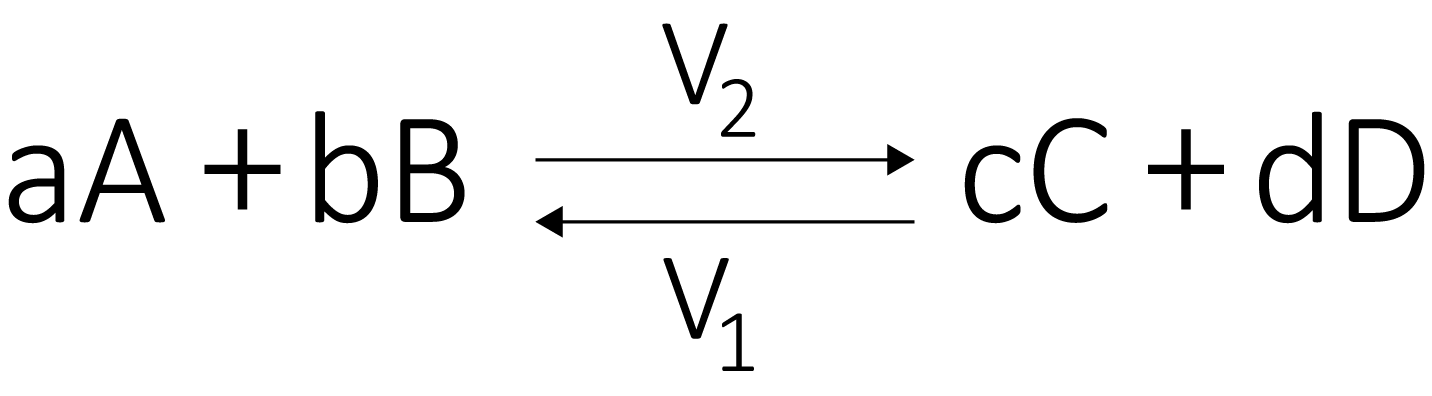
Na situação de equilíbrio, temos que \({{V}_{1}}={{V}_{2}}\). É importante frisar que no estado de equilíbrio, a reação não para, apenas as velocidades de decomposição dos reagentes e dos produtos é a mesma. Para que tal estado possa ocorrer, o sistema deve ser fechado e a temperatura constante, assim como as concentrações de reagentes e produtos.
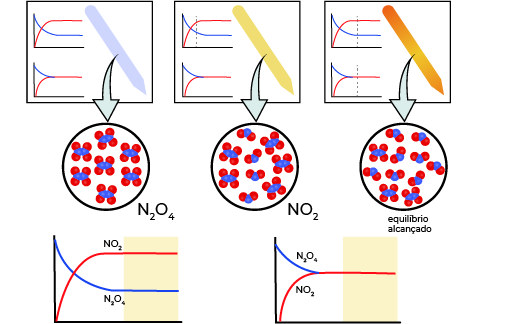
Uma mistura de \(N{{O}_{2}}\) e \({{N}_{2}}{{O}_{4}}\) se move em direção ao equilíbrio. O \({{N}_{2}}{{O}_{4}}\) incolor reage para formar \(N{{O}_{2}}\) marrom. À medida que a reação prossegue em direção ao equilíbrio, a cor da mistura escurece devido à crescente concentração de \(N{{O}_{2}}\).
Fonte: https://opentextbc.ca/chemistry/chapter/13-1-chemical-equilibria/
Grau de equilíbrio: é a porcentagem em mols de uma espécie que reagiu até alcançar o equilíbrio. Pode ser dada por α=quantidade de mols que reagiu/quantidade de mols inicial.
Constante de equilíbrio em termos de concentrações molares (\({{K}_{c}}\)): usando as leis das velocidades, considerando que \({{V}_{1}}={{V}_{2}}\), teremos então que a constante de equilíbrio \({{K}_{c}}=\frac{{{[C]}^{c}}\cdot{{[D]}^{d}}}{{{[A]}^{a}}\cdot {{[B]}^{b}}}\).
É importante lembrar que \({{K}_{c}}\) varia com a temperatura, também que quanto maior o valor de \({{K}_{c}}\), maior o rendimento da reação e que tal constante não apresenta unidade.
Constante de equilíbrio em termos de pressões parciais (\({{K}_{p}})\): Quando temos reagentes e produtos gasoso, podemos expressar a constante de equilíbrio a partir das pressões parciais por \({{K}_{p}}=\frac{{{(pC)}^{c}}\cdot{{(pD)}^{d}}}{{{(pA)}^{a}}\cdot {{(pB)}^{b}}}\).
Vale ressaltar que em sistemas heterogêneos, com coexistência de diferentes estados físicos, o estado sólido não entra na expressão de \({{K}_{p}}\) e \({{K}_{c}}\), e o estado líquido não consta na expressão de \({{K}_{p}}\).
Relação entre \({{K}_{c}}\) e \({{K}_{p}}\): as constantes podem ser relacionadas pela equação \({{K}_{p}}={{K}_{c}}\cdot{{(R\cdot T)}^{\Delta n}}\), onde Δn é a variação da quantidade em mols de produtos e reagentes, T é a temperatura e R a constante dos gases (R=0,082 atm.L/mol.K ou 62,3 mmHg.L/mol.K).
Deslocamento de equilíbrio: é a ação de fatores que alteram as velocidades \({{V}_{1}}\) ou \({{V}_{2}}\), até que se atinja um novo equilíbrio onde as concentrações de reagentes e produtos serão diferentes daquelas no equilíbrio inicial. Se nesse novo equilíbrio, a concentração de produtos for maior que aquela do equilíbrio inicial, temos que a reação foi deslocada para a direita (na direção dos produtos). Já se neste novo equilíbrio, a concentração de reagentes for superior àquela do equilíbrio inicial, temos uma reação deslocada para a esquerda (na direção dos reagentes).
Deslocamento de equilíbrio por conta do aumento da pressão Princípio de Le Chatelier: um sistema em equilíbrio, quando sofre ação de uma força externa, se desloca de modo a anular a força aplicada. Tais forças são pressão, temperatura e concentração de reagentes ou produtos.
Concentração: o aumento na concentração de reagentes ou produtos desloca a reação no sentido de consumir o componente adicionado. Consequentemente, há também o aumento da velocidade em tal sentido. Já a diminuição da concentração de um dos componentes desloca a reação no sentido de repor a substância retirada, diminuindo a velocidade de obtenção do componente retirado. No caso de sistemas com todos os componentes gasosos, temos o comportamento da alteração das pressões parciais acontecendo da mesma forma que tratado nas concentrações, ou seja, aumentando a pressão de um dos reagentes, desloca a reação no sentido de formar o produto, e vice-versa.
Pressão total do sistema: já em relação ao efeito da pressão total do sistema, temos que o aumento desta ocasiona o deslocamento da reação no sentido do menor volume gasoso, ou seja, para o membro com o menor número de mols total. Se ambos os membros têm o mesmo número de mols, a variação da pressão total não ocasionará alteração no sistema.
Temperatura: o aumento da temperatura desloca a reação no sentido endotérmico, já uma diminuição da temperatura desloca a reação no sentido exotérmico. É importante ressaltar que a temperatura é o único fator que altera tanto o equilíbrio da reação quanto o valor da constante de equilíbrio. O aumento da temperatura aumenta o valor da constante de equilíbrio, e vice-versa.
(UNIRIO – RJ) “O conceito de equilíbrio é fundamental na química, mas não é exclusivo da química. Vivemos em uma situação social e econômica que constitui equilíbrio dinâmico de forças competitivas. Na família e nos grupos sociais, comportamo-nos de maneira a manter as relações mais cordiais possíveis. Na realidade, procuramos atingir um equilíbrio”.
(Kotz e Treichel, 1998)
Acerca do tema equilíbrio químico, podemos afirmar que:
(UEPG – PR) O principal processo industrial de fabricação do ácido sulfúrico consiste no chamado processo de contato, no qual a etapa chave de fabricação é a reação de oxidação do \(S{{O}_{2(g)}}\) na superfície de um catalisador:
\[S{{O}_{2(g)}}+{{O}_{2(g)}} \rightleftarrows S{{O}_{3(g)}}\,\,\,\Delta H<0\]
Considere este sistema gasoso em equilíbrio, acerte os coeficientes da equação e assinale o que for correto sobre seu comportamento.
(UFSCAR) Em 1912, o químico alemão Fritz Haber desenvolveu um processo para sintetizar amônia diretamente dos gases nitrogênio e hidrogênio. Este processo é muito importante economicamente, porque a amônia é bastante utilizada, por exemplo, na indústria de fertilizantes.
Considere a reação em equilíbrio químico num sistema fechado
\[{{N}_{2(g)}}+3{{H}_{2(g)}} \rightleftarrows 2N{{H}_{3(g)}}\]
Mantendo-se a temperatura constante, algumas modificações podem ser realizadas nesse sistema:
I. introdução de \({{N}_{2(g)}}\);
II. aumento da pressão do sistema;
III. adição de catalisador.
As modificações que irão provocar o deslocamento do equilíbrio, favorecendo a formação de \(N{{H}_{3}}\), são:
(UFC – CE) Considerando um reservatório mantido à temperatura constante, tem-se estabelecido o equilíbrio químico \(PC{{l}_{5(g)}} \rightleftarrows PC{{l}_{3(g)}}+C{{l}_{2(g)}}\). Sendo que as pressões parciais no equilíbrio são \({{P}_{PC{{l}_{5}}}}=0,15atm\), \({{P}_{PC{{l}_{3}}}}=0,30atm\) e \({{P}_{PC{{l}_{2}}}}=0,10atm\). Assinale a alternativa correta para o valor de Kp (em atm) da reação.
(UEPB) 6,8 gramas de amônia são aquecidos em um recipiente fechado a uma dada temperatura. Quando o sistema atinge o equilíbrio, verifica-se a formação de 0,6 grama de hidrogênio. Qual é o grau de dissociação do \(N{{H}_{3}}\) nas condições da experiência? Dados: N = 14 e H = 1.
(UFRN – RN) Sabendo-se que \({{K}_{p}}={{K}_{c}}\,{{(RT)}^{\Delta n}}\), podemos afirmar que \({{K}_{p}}={{K}_{c}}\), para:
(ITA - SP) As opções abaixo se referem a equilíbrios químicos que foram estabelecidos dentro de cilindros providos de êmbolos. Se o volume interno em cada cilindro for reduzido à metade, a temperatura permanecendo constante, em qual das opções abaixo o ponto de equilíbrio será alterado?
(UFTM – MG) A presença de \(S{{O}_{2}}\) e \(S{{O}_{3}}\) na atmosfera, entre outros gases, possibilita a formação da chuva ácida. A equação que representa o equilíbrio químico de decomposição do trióxido de enxofre é:
\[2S{{O}_{3(g)}}\,\to\,2S{{O}_{2(g)}}+{{O}_{2(g)}}\]
Os valores das constantes de equilíbrio a 298 K e 500 K são respectivamente iguais a \(2,5\times{{10}^{-25}}\) e \(2,5\times{{10}^{-11}}\).
Considere as afirmações sobre o equilíbrio em questão:
I. a decomposição do \(S{{O}_{3}}\) é uma reação endotérmica;
II. a decomposição do \(S{{O}_{3}}\) é favorecida pelo aumento da pressão;
III. a concentração do \(S{{O}_{2}}\) aumenta com o aumento da temperatura;
IV. a presença de um catalisador não altera o equilíbrio.
Está correto o contido apenas em
(UFC – CE) A aplicação do princípio de Le Chatelier possibilita o controle da direção e da extensão de uma determinada reação química. Um exemplo típico é o equilíbrio entre as formas cor de rosa e azul dos íons cobalto.
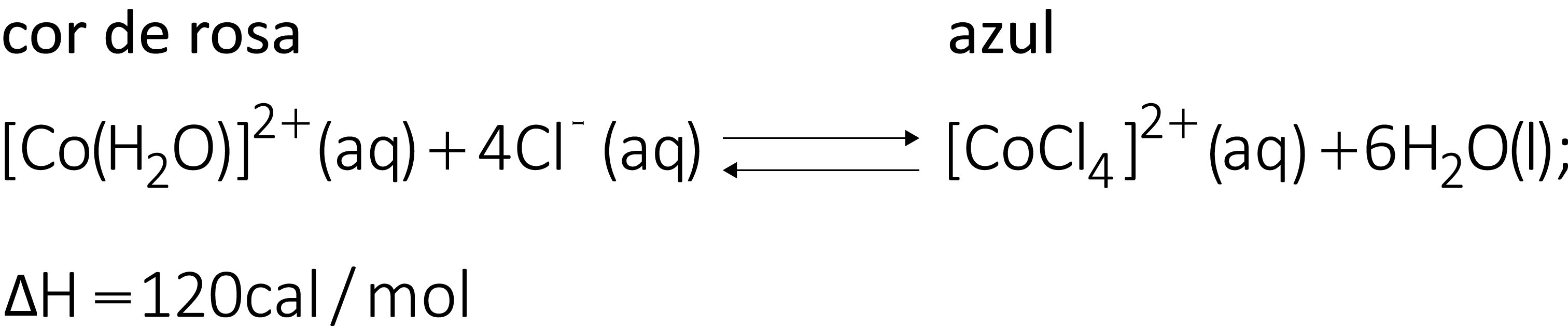
Assinale a alternativa que apresenta uma ação sobre o sistema, que favorece a formação da solução de cor azul.
(UFC – CE) Uma das reações que podem ocorrer em uma atmosfera poluída é representada pelo equilíbrio químico abaixo:
\[2N{{O}_{(g)}}+{{O}_{2(g)}}\,\rightleftarrows\,2N{{O}_{2(g)}}\,\,\,\Delta H>0\]
Considerando tratar-se de uma reação simples e elementar, analise as afirmativas abaixo e marque a alternativa correta.
(FUVEST - SP) O Brasil produz, anualmente, cerca de 6 × 106 toneladas de ácido sulfúrico pelo processo de contacto. Em uma das etapas do processo há, em fase gasosa, o equilíbrio
\[2S{{O}_{2(g)}}+{{O}_{2}}\,\rightleftharpoons\,2S{{O}_{3(g)}}\,\,\,\,\,KP=4,0\times {{10}^{4}}\]
que se estabelece à pressão total de P atm e temperatura constante. Nessa temperatura, para que o valor da relação \(\frac{x_{S{{O}_{3}}}^{2}}{x_{S{{O}_{2}}}^{2}{{X}_{{{O}_{2}}}}}\) seja igual a \(6,0\times {{10}^{4}}\), o valor de P deve ser:
x = fração em quantidade de matéria (fração molar) de cada constituinte na mistura gasosa
\({{K}_{p}}\) = constante de equilíbrio
(FUVEST - SP) A transformação de um composto A em um composto B, até se atingir o equilíbrio \((A \rightleftarrows B)\), foi estudada em três experimentos. De um experimento para o outro, variou-se a concentração inicial do reagente A ou a temperatura ou ambas. Registraram-se as concentrações de reagente e produto em função do tempo.
Com esses dados, afirma-se:
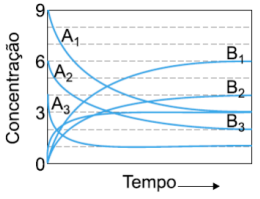
Com esses dados, afirma-se:
I. Os experimentos 1 e 2 foram realizados à mesma temperatura, pois as constantes de equilíbrio correspondentes são iguais.
II. O experimento 3 foi realizado numa temperatura mais elevada que o experimento 1, pois no experimento 3 o equilíbrio foi atingido em um tempo menor.
III. A reação é endotérmica no sentido da formação do produto B.
Dessas afirmações,
(UEPG – PR) Sobre as características de uma reação que atinge o estado de equilíbrio químico, a uma dada temperatura, assinale o que for correto.
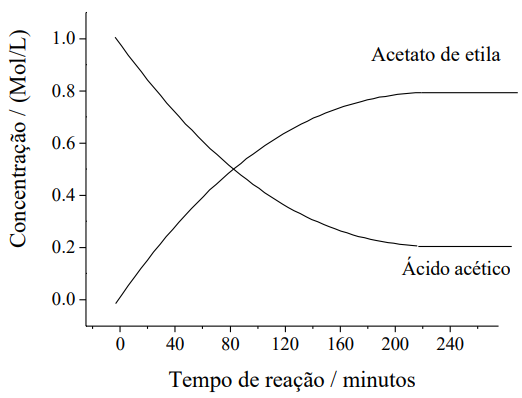
(UEM – PR) Dada a reação, em que o etanol está em excesso, \(C{{H}_{3}}COOH+C{{H}_{3}}C{{H}_{2}}OH\,\,\overset{H+}{\leftrightarrows}\,C{{H}_{3}}COOC{{H}_{2}}C{{H}_{3}}+{{H}_{2}}O\) e o gráfico de consumo do ácido acético e formação dos produtos em função do tempo, assinale o que for correto.
(UECE – CE) Alguns medicamentos são apresentados na forma de comprimidos que, quando ingeridos, dissolvem-se lentamente no líquido presente no tubo digestório, garantindo um efeito prolongado no organismo. Contudo, algumas pessoas, por conta própria, amassam o comprimido antes de toma-lo.
Esse procedimento é inconveniente, pois reduz o efeito prolongado devido
(UFMS - MS) O conceito de equilíbrio é fundamental, porém não é exclusivo da química; procura-se, também, atingir o equilíbrio nas famílias, nos grupos sociais e nas relações internacionais.
A respeito do equilíbrio químico gasoso, homogêneo e genérico:
\(aA+bB \rightleftharpoons \, cC+dD\),
é correto afirmar que
(UFSC – SC) Em grandes cidades, tais como São Paulo e Rio de Janeiro, a presença de milhões de veículos provoca um dos piores problemas de poluição atmosférica devido à emissão do monóxido de nitrogênio, dentre outros gases. No cilindro de um motor de automóvel de alta compressão, as temperaturas durante a queima do combustível podem ser da ordem de 2.400 K. Essas condições favorecem a combustão do nitrogênio, representada pela equação química abaixo:
\[{{N}_{2(g)}}+{{O}_{2(g)}}+180,8KJ\,\rightleftharpoons\,2N{{O}_{(g)}}\]
Sabe-se que a constante de equilíbrio para a formação de um mol de NO a 300 K é igual a \({{10}^{-13}}\), enquanto que à temperatura de 2.400 K o valor da constante é \({{10}^{13}}\) vezes maior.
Com base nas informações fornecidas e na equação balanceada, assinale a(s) proposição(ões) CORRETA(S).
(UFMS – MS) Supõe-se que a 2000ºC a reação \({{H}_{2}}_{(g)}+C{{O}_{2(g)}}\,\to\,{{H}_{2}}{{O}_{(g)}}+C{{O}_{(g)}}\) apresenta KC = 4,00. Injetando–se 1,00 mol de cada componente \(({{H}_{2}},\,\,C{{O}_{2}},\,\,{{H}_{2}}O,\,\,CO)\), simultaneamente, num recipiente de 10,0 litros, e deixando-os entrar em equilíbrio à temperatura acima, é correto afirmar que, no equilíbrio,
(IME – RJ) Um vaso fechado de volume V contém inicialmente dois moles do gás A. Após um determinado tempo, observa-se o equilíbrio químico: \(A \rightleftarrows 2B\) cuja constante de equilíbrio é \({{K}_{p}}= \frac {P_{B}^{2}}{{{P}_{A}}}\) (onde \({{P}_{A}}\) e \({{P}_{B}}\) representam as pressões parciais dos componentes A e B). No equilíbrio, o número de moles de A é \({{n}_{1}}\). Em seguida, aumenta-se a pressão do vaso admitindo-se dois moles de um gás inerte I. Após novo equilíbrio, o número de moles de A é \({{n}_{2}}\). Quanto vale se, durante todo o processo, \({{n}_{2}}/{{n}_{1}}\) a temperatura fica constante e igual a T (em K) ?
(UEM – PR) Considerando a reação abaixo, feita em um recipiente fechado, assinale o que for correto.
\[2N{{O}_{2(g)}}+7{{H}_{2(g)}}\rightleftarrows2N{{H}_{3(g)}}+4{{H}_{2}}{{O}_{(l)}}\]
(UFRGS) Para a obtenção de um determinado produto, realiza-se uma reação em 2 etapas. O caminho dessa reação é representado no diagrama abaixo.
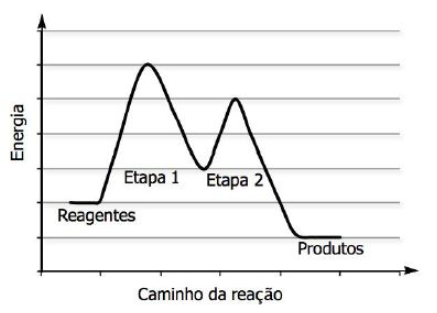
Considere as afirmações abaixo, sobre essa reação.
I. A etapa determinante da velocidade da reação é a etapa 2.
II. A reação é exotérmica.
III. A energia de ativação da etapa 1 é a maior que a energia de ativação da etapa 2.
Quais estão corretas?
(UEM – PR) Considerando que a reação
\[AB_{(aq)}^{-}+C(g)\,\rightleftarrows\, AC_{(aq)}^{+}+B_{(aq)}^{2-}\]
possui, ∆H = -45Kcal que está sob equilíbrio e que ocorre em um recipiente hermeticamente fechado de volume variável, assinale a alternativa correta
(Obs.: considere as espécies \(AB_{(aq)}^{-}\) e \({{C}_{(g)}}\) como os reagentes e as espécies \(AC_{(aq)}^{+}\) e \(B_{(aq)}^{2-}\) como os produtos.).
(UFJF) Um estudante resolveu fazer três experimentos com comprimidos efervescentes, muito utilizados no combate à azia, que liberam \(C{{O}_{2}}\) quando dissolvidos em água.
Experimento 1: Em três copos distintos foram adicionados a mesma quantidade de \({{H}_{2}}O\), mas com temperaturas diferentes (-6,25 a 100 °C). Em seguida, foi adicionado um comprimido efervescente inteiro em cada copo.
Experimento 2: Em dois copos distintos foi adicionada a mesma quantidade de \({{H}_{2}}O\) à temperatura ambiente. Ao primeiro copo foi adicionado um comprimido inteiro e ao segundo um comprimido triturado.
Experimento 3: Em três copos distintos foram adicionados a mesma quantidade de \({{H}_{2}}O\) à temperatura ambiente e ½, 1 e 1 ½ comprimido não triturado, respectivamente. Com base nos parâmetros que influenciam a cinética de uma reação química, o estudante deve observar que:
(UEPG – PR) O óxido de nitrogênio (NO), comumente denominado óxido nítrico, é utilizado como reagente de partida para a síntese industrial de outras substâncias. Industrialmente, o óxido nítrico é sintetizado conforme a reação não-balanceada

Considerando que a reação é exotérmica e que ela ocorre em um recipiente fechado, assinale o que for correto.
(PUC – MG) Considere uma reação endotérmica que possui uma energia de ativação de 1200 kJ e uma variação de entalpia de 200 kJ. Com a adição de um catalisador, a nova energia de ativação é de 800 kJ. É INCORRETO afirmar:
(UFRN – RN) Em geral, o ponto de partida para processos de produção industrial de fertilizantes, corantes e outros produtos nitrogenados fabricados em alta escala, é a síntese da amônia \((N{{H}_{3}})\) em fase gasosa, a partir do nitrogênio atmosférico \(({{N}_{2}})\), abaixo equacionada.
\({{N}_{2(g)}}+3{{H}_{2(g)}}\,\rightleftarrows \,2N{{H}_{3(g)}}\]
Para que seja favorecida a formação de amônia \((N{{H}_{3}})\), é necessário que se desloque a reação para a direita, por variação na pressão, temperatura ou concentração de componente.
O gráfico que representa corretamente o deslocamento do equilíbrio dessa reação causado por adição de reagente é:
(UNB – DF) O \(C{{O}_{2}}\) resultante da respiração celular, ao ser liberado pelas células, antes de ser expirado, pode permanecer no organismo, dissolvido no plasma sanguíneo, onde reage com a água, em um processo denominado hidrólise. A reação de hidrólise do dióxido de carbono pode ser representada pela equação.
\(2{{H}_{2}}O(l)+C{{O}_{2}}\) (dissolvido) \(D\,HC{{O}^{-}}_{3}(aq)+{{H}_{3}}{{O}^{+}}(aq)\), cuja constante de equilíbrio é igual a \(4,44\times{{10}^{7}}\,\).
Em geral, essa reação se processa muito lentamente. Entretanto, sob a ação de uma enzima denominada anidrase carbônica, a velocidade dessa reação pode ser aumentada por um fator de até \(1,0\times {{10}^{7}}\,\) comparativamente à reação não-catalisada.
Julgue os itens abaixo, relativos ao texto.
(UEM – PAS) A precipitação de chuvas ácidas nos grandes centros se deve, principalmente, à queima de combustíveis fósseis, fato gerador de grandes quantidades do gás dióxido de enxofre \((S{{O}_{2}})\). Esse componente químico, na presença de óxido de nitrogênio (NO), reage com o gás oxigênio \(({{O}_{2}})\) da atmosfera (Reação A) e o produto da reação A reação com água (Reação B) formando a chuva ácida.
\[\begin{align} & 2S{{O}_{2(g)}}+{{O}_{2(g)}}\,\xrightarrow [N{{O}_{(g)}}]{}2S{{O}_{3(g)}}\,(\operatorname Reação A) \\ & \\ & S{{O}_{2(g)}}+{{H}_{2}}{{O}_{(l)}}\,\to {{H}_{2}}S{{O}_{4(aq)}}\,\,(\operatorname Reação B) \\ \end{align}\]
Sobre essas informações, assinale o que for correto.
(UEM – PR) Em um recipiente fechado de volume igual a 1 litro, 34 g de \({{H}_{2}}{{S}_{(g)}}\) sofrem decomposição à temperatura constante, de acordo com a reação abaixo.
\[{{H}_{2}}{{S}_{(g)}}\,\,\Leftrightarrow\,2{{H}_{2(g)}}+{{S}_{2(g)}}\]
Depois de estabelecido o equilíbrio químico, verifica-se a presença de 3,4 g de \({{H}_{2}}{{S}_{(g)}}\). Considerando essas afirmações, responda o que se pede a seguir:
(UFPR – PR) A reação de hidrólise da acetilcolina, esquematizada abaixo, é fundamental na transmissão de impulsos nervosos nos seres vivos. A reação é promovida pela enzima acetilcolinesterase (AChE).
Considere as seguintes afirmativas sobre o papel de AChE nessa reação:
I. AChE é catalisador da reação.
II. AChE aumenta a energia de ativação da reação.
III. AChE promove caminhos reacionais alternativos.
IV. AChE inibe a formação de intermediários.
Assinale a alternativa correta.
Você chegou ao fim dessa aula com sucesso!
Selecione o botão avançar para seguir para a próxima aula.