A facilidade de desidratação nos álcoois é, em ordem decrescente, nos terciários, depois nos secundários e por último nos primários.
A desidratação intramolecular necessita de catalisador, \({{H}_{2}}S{{O}_{4}}\) ou \(A{{l}_{2}}{{O}_{3}}\) e um aquecimento maior que a intermolecular.
\[{{H}_{3}}C-\overset{\begin{smallmatrix} OH \\ | \end{smallmatrix}}{\mathop{C{{H}_{2}}}}\,-C{{H}_{2}}\to\,{{H}_{3}}C-CH=C{{H}_{2}}+{{H}_{2}}O\]
O alceno mais estável é aquele que apresenta o maior número de radicais orgânicos ligados aos átomos de carbono da dupla ligação.
\[\begin{matrix} \begin{matrix} \begin{matrix} \begin{matrix} \begin{matrix} \begin{matrix} \begin{matrix} {} & {} \\ \end{matrix} & {} \\ \end{matrix} & {} \\ \end{matrix} & {} \\ \end{matrix} & {} \\ \end{matrix} & {} \\ \end{matrix}{{H}_{3}}C-CH-C{{H}_{3}} \\ 2{{H}_{3}}C-CH-C{{H}_{3}}\to \,{{H}_{3}}C-\overset{\begin{smallmatrix} | \\ O \\ | \end{smallmatrix}}{\mathop{CH}}\,-C{{H}_{3}}+{{H}_{2}}O \\ \end{matrix}\]
Verifica-se reação de eliminação, quando haletos orgânicos encontram-se em presença de KOH alcoólico.
\[{{H}_{3}}C-\underset{\begin{smallmatrix} + \\ KOH \end{smallmatrix}}{\mathop{C{{H}_{2}}}}\,-\overset{\begin{smallmatrix} Cl \\ | \end{smallmatrix}}{\mathop{C{{H}_{2}}}}\,\xrightarrow[\Delta]{alcool}\underset{\begin{smallmatrix} + \\ KCl \end{smallmatrix}}{\mathop{\,{{H}_{3}}C-CH=CH+{{H}_{2}}O}}\,\]
Nas situações em que pode ser obtido mais de um alceno, seguimos a regra de Saytzeff.
Os ácidos desidratam-se na presença de desidratantes (\({{H}_{2}}S{{O}_{4}},\,{{H}_{3}}P{{O}_{4}}\) ou \({{P}_{2}}{{O}_{5}}\)), produzindo anidridos de ácidos.
\[\begin{matrix} \begin{matrix} \begin{matrix} \begin{matrix} 2{{H}_{2}}O &\underset{\begin{smallmatrix} \backslash \\ OH \end{smallmatrix}}{\overset{\begin{smallmatrix} O \\ // \end{smallmatrix}}{\mathop{C}}}\, \\ \end{matrix} & \xrightarrow[140{}ºC]{{{H}_{2}}S{{O}_{4}}} \\ \end{matrix} & {{H}_{3}}C &\underset{\begin{smallmatrix} \backslash \\ O \\ / \end{smallmatrix}}{\overset{\begin{smallmatrix} O \\ // \end{smallmatrix}}{\mathop{C}}}\,+{{H}_{2}}O \\ \end{matrix} \\ \begin{matrix} \begin{matrix} {} & {} \\ \end{matrix} & {} & {} & \begin{matrix} {} &{{H}_{3}}C-C \\ \end{matrix} \\ \end{matrix} \\ \end{matrix}\]
As reações de oxirredução são as que ocorrem com mudança do número de oxidação.
É a reação de alcenos com ozônio (\(${{O}_{2}}\)), formando ozonetos ou ozonídeos, seguida por hidrólise (quebra pela água) do ozoneto formado, permitindo a obtenção de aldeído ou cetona com formação de peróxido de hidrogênio.
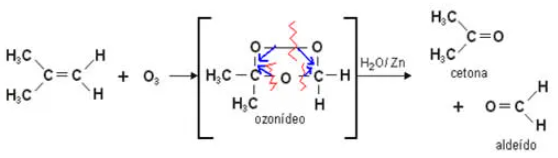
Os alcenos são oxidados pelo \(KMn{{O}_{4}}\) (permanganato de potássio) em meio básico (\(NaHC{{O}_{3}}\) ou \(N{{a}_{2}}C{{O}_{3}}\)) ou neutro, formando glicóis. O oxidante brando mais usado é o \(KMn{{O}_{4}}/NaHC{{O}_{3}}\), conhecido como reativo de Bayer.
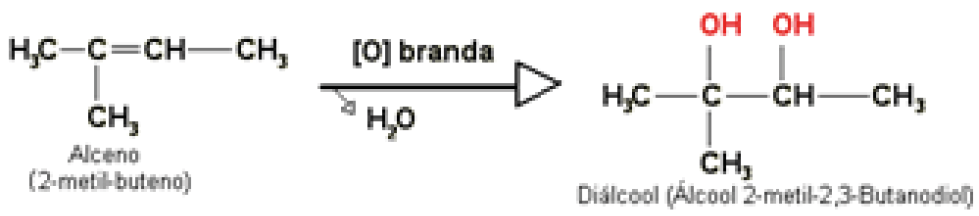
Caracterizadas quando um alceno é submetido a um oxidante enérgico, sofrendo oxidação com ruptura da dupla ligação, podendo ocorrer a formação de ácidos carboxílicos, cetonas ou gás carbônico.
Alguns exemplos de oxidantes enérgicos: mistura sulfopermangânica \((KMn{{O}_{4}}/{{H}_{2}}C{{O}_{4}})\) e mistura sulfocrômica \(({{K}_{2}}C{{r}_{2}}{{O}_{4}}/{{H}_{2}}S{{O}_{4}})\).
Álcool Primário: Os álcoois primários podem sofrer oxidação parcial ou total, produzindo aldeído e ácido carboxílico respectivamente.
Álcool Secundário: São oxidados a cetonas.
Álcool Terciário: Não sofrem reação de oxidação.
Corresponde à queima de um composto, usando o gás oxigênio como comburente. A combustão completa dos compostos orgânicos produz dióxido de carbono \((C{{O}_{2}})\) e água na forma de vapor. Se a combustão for incompleta, além de água pode haver a formação de monóxido de carbono e fuligem; isto se deve à quantidade insuficiente de oxigênio molecular \((C{{O}_{2}})\) para realizar a combustão total.
Esta reação é a reação de formação de um éster e água, através de um álcool e um ácido.
Sabões são sais de ácidos graxos obtidos pela reação de óleos ou gorduras com bases fortes.
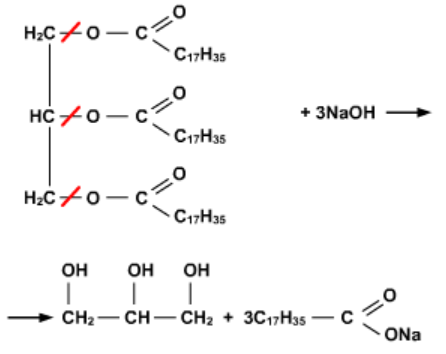
(PUC – PR) A reação de ozonólise dos alcenos produzirá moléculas de:
(EFOA - MG) A energia liberada pela queima do etanol pode ser usada tanto em motores de combustão interna, como no cozimento de alimentos. Esta reação de combustão está representada pela equação não balanceada abaixo:
\[C{{H}_{3}}C{{H}_{2}}O{{H}_{(l)}}+{{O}_{2(g)}}\to\,C{{O}_{2(g)}}+{{H}_{2}}{{O}_{(g)}}\]
A soma dos coeficientes mínimos inteiros que balanceiam CORRETAMENTE a equação acima é:
(UFRGS - RS) A combustão de uma substância ocorre:
(UECE - CE) O pioneiro no uso do etoxietano (éter comum) para fins anestésicos foi o Doutor Crawford W. Long, em 1842, quando usou essa substância para remover tumores do pescoço de um paciente. O etoxietano pode ser obtido
(PUC/RJ) A reação de desidratação intramolecular de álcoois leva à obtenção de:
(PUC - MG) O ácido acetilsalicílico ou Aspirina® pode ser facilmente preparado em laboratório pela reação do ácido salicílico com anidrido acético e um catalisador ácido, conforme a reação mostrada abaixo.
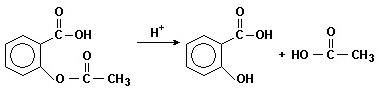
Com base no esquema acima e em seus conhecimentos, analise as afirmativas abaixo e marque a INCORRETA.
(ITA - SP) Aquecendo, juntos, ácido benzóico e etanol podemos esperar a formação de:
(FEPECS - DF) A aromaterapia estuda os efeitos do que cada diferente cheiro pode provocar, cheiros esses que ficam guardados de forma concentrada em óleos. Esses óleos são acrescentados a cremes de massagem, a banhos de imersão e são usados até mesmo para perfumar ambientes. Cada essência produz um efeito diferente. Uma das substâncias utilizadas na aromaterapia é o óleo de menta, cuja fórmula estrutural está representada a seguir:
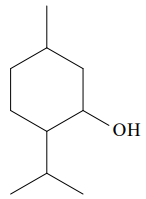
O produto principal de sua oxidação é:
(UFMS - MS) No Brasil, dirigir alcoolizado, ou seja, com nível de álcool no sangue superior a 0,6g/L, é crime. O bafômetro é uma aparelhagem usada na detecção de vapores de álcool, quando presentes no ar expirado por um indivíduo alcoolizado. Basicamente, o ar expirado é coletado através de um tubo de vidro adaptado à boca e a uma proveta com solução aquosa ácida padronizada de dicromato, alaranjada, que passa para verde, após a reação com álcool. Considerando a reação global do processo:
\[{{C}_{2}}{{H}_{6}}{{O}_{(aq)}}+C{{r}_{2}}{{O}_{7}}{{^{2-}}_{(aq)}}+{{H}^{+}}_{(aq)}\to\,C{{r}^{3+}}_{(aq)}+{{C}_{2}}{{H}_{4}}{{O}_{(aq)}}+{{H}_{2}}{{O}_{(l)}}\]
é correto afirmar que:
(UEM - PR) Assinale o que for correto.
(ACAFE - SC) O vinho, bebida alcoólica proveniente da uva, quando guardado em garrafa aberta, após certo tempo, “azeda”, transformando-se em vinagre. Esse fenômeno ocorre porque o álcool contido no vinho sofre uma:
(ITA - SP) Qual das opções apresenta uma substância que ao reagir com um agente oxidante ([O]), em excesso, produz um ácido carboxílico?
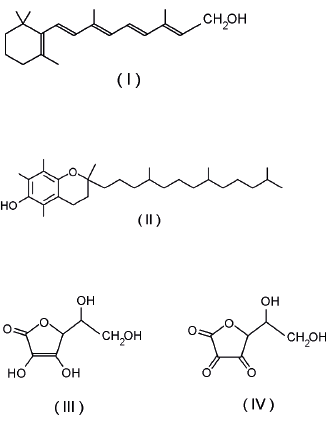
(UEPG - PR) Os agentes antioxidantes protegem o organismo contra os radicais livres, intermediários reativos de oxigênio, que participam em muitos processos degenerativos e patológicos. Entre esses agentes oxidantes figuram o retinol (I), o tocoferol (II) e também o ácido ascórbico (III), que se transforma no ácido dehidroascórbico (IV), conforme as estruturas abaixo. Com relação a este assunto, assinale o que for correto.
(UECE - CE) A reação de oxidação dos álcoois secundários produz compostos oxigenados, conforme a reação:
\[\begin{matrix} R-\underset{\begin{smallmatrix} | \\ R' \end{smallmatrix}}{\overset{\begin{smallmatrix} H \\ | \end{smallmatrix}}{\mathop{C}}}\,-OH\xrightarrow{oxidação}X \\ Álcool\, secundário \\ \end{matrix}\]
O composto X é um(a)
(UEG - GO) Alcenos são hidrocarbonetos que apresentam ligação dupla entre átomos de carbono. São chamados de olefinas, palavra que significa “gerador de óleos”, em razão do aspecto oleoso dos que têm mais de cinco carbonos.
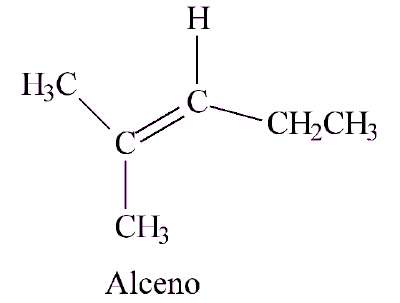
Com base na fórmula química do alceno apresentada acima, considere as seguintes afirmativas:
I. De acordo com a nomenclatura IUPAC, o composto é o 2-metil-2-penteno.
II. Alcenos são mais reativos do que alcanos por causa da ligação dupla entre átomos de carbono.
III. Na adição iônica de HBr, o átomo de bromo se ligará ao carbono menos hidrogenado da dupla ligação.
IV. Esse composto apresenta isomeria cis-trans.
V. Sob condições reacionais adequadas, na reação de ozonólise, podem ser obtidos como produtos a propanona e o propanal.
Marque a alternativa CORRETA:
(UFTM - MG) Leia o texto a seguir.
O Ministério da Saúde tem veiculado propagandas antitabagistas bastante agressivas. Um folheto contém a foto de um jovem fumando e as seguintes informações:
Cigarro - Altos Teores de Enganação
O cigarro tem muito mais que nicotina e alcatrão. A cada tragada, o fumante manda para dentro de seu organismo um coquetel de substâncias químicas que fazem mal e que os fabricantes não mostram para você. Veja algumas das substâncias que o cigarro contém e fique esperto, porque, antes de enrolar o cigarro, os fabricantes enrolam você.

Veneno empregado pra afastar baratas, a naftalina provoca tosse, irritação na garganta e náuseas. O contato prolongado com a substância ataca os rins e os olhos.

Usada para limpeza de banheiros, a amônia pode cegar e até matar. Ela é adicionada pelos fabricantes para acentuar o sabor do tabaco e aumentar a absorção da nicotina.

Usado para tingir cabelos, é um cancerígeno que, inalado ou ingerido, atrapalha no crescimento, causa dor de cabeça e pode gerar câncer no pulmão e nos rins.

Cancerígeno presente em tintas spray, a simples inalação do xileno irrita fortemente a vista, causa tontura, dor de cabeça e perda de consciência.
Os xilenos podem ser sintetizados a partir do tolueno (metilbenzeno). Na substituição do H pelo grupo metil no tolueno, tem-se como principal produto o composto
(UNIRIO - RJ) Um dos capítulos mais interessantes da Química no Ensino Médio é o que se refere às reações de compostos orgânicos.
Acerca das reações de compostos orgânicos, podemos afirmar que:
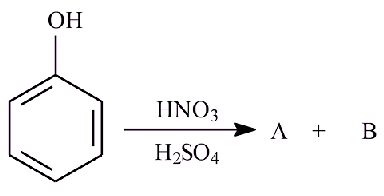
(UEG - GO) Nas reações de substituição aromática eletrofílica, o grupo ligado ao anel aromático influencia diretamente a posição em que o eletrófilo se ligará no anel. A reação de nitração do fenol é um exemplo dessa reação e leva à formação preferencial dos isômeros A e B. Considerando essa reação, responda aos itens abaixo:
(MACKENZIE - SP) Do butano, gás utilizado para carregar isqueiros, fazem-se as seguintes afirmações.
I. Reage com o cloro por meio de reação de substituição.
II. É isômero de cadeia do metil-propano.
III. Apresenta, no total, treze ligações covalentes simples.
Dessas afirmações,
(UFAM - AM) O 2-metil-propano, ao reagir com gás cloro, na presença de luz, e a 25ºC, dará dois compostos isômeros de proporções diferentes. São eles:
(UEM - PR) Sabendo-se que a substância responsável pelo aroma característico da maçã verde é o etanoato de etila, assinale o que for correto.
(UEPG - PR) A carnitina é um composto biológico que atua no transporte intracelular de ácidos graxos, no processo denominado lançadeira de carnitina, possibilitando a oxidação dos mesmos. Neste processo, a carnitina reage com os ácidos graxos formando ésteres.
Analise a estrutura da carnitina e do ácido graxo e assinale o que for correto.
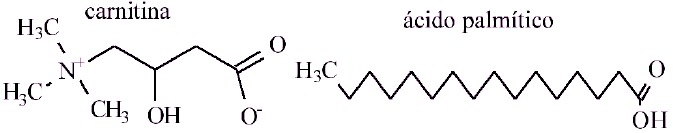
(UFU - MG) No balão de reação, conforme figura a seguir, foram colocados 12 mL de ácido acético (etanóico) e 15 mL de etanol absoluto. Em seguida, adicionou-se, cuidadosamente, 2 mL de ácido sulfúrico concentrado e aqueceu-se a mistura reagente. Entre a temperatura de 68 - 78°C, observada no termômetro, destilou-se uma fração que continha o produto desta reação, o qual foi recolhido no frasco coletor.
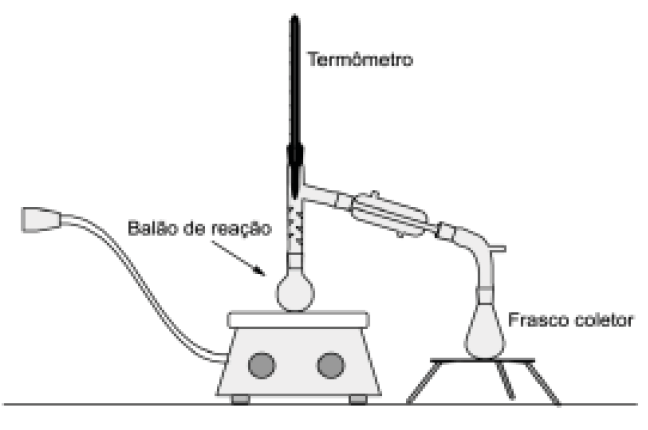
Após as etapas de purificação necessárias, o produto principal desta reação foi
(UFPA - PA) O mate é uma bebida com ação estimulante mais prolongada que a do café, não causando, porém, irritabilidade ou insônia. Entre os componentes voláteis do mate são encontrados os ácidos propiônico, butírico, valérico e capróico.
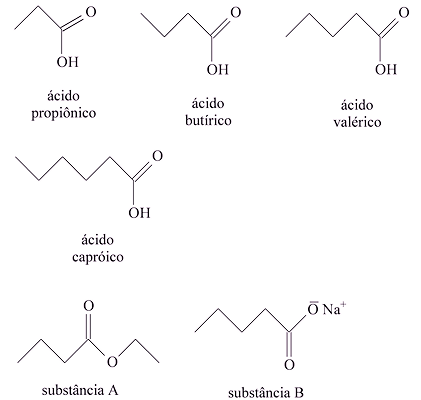
Considerando as estruturas químicas representadas acima, faça o que se pede:
(UEPB – PB) Os ésteres são os responsáveis pelo flavor, aroma mais sabor, de produtos industrializados. O acetato de octila possui o flavor da laranja. Das opções abaixo, qual o nome da reação que pode produzir o supracitado composto e quais os seus reagentes?
(FGV - SP) O Brasil destaca-se no cenário internacional com a produção e incentivo do uso de combustíveis de fontes renováveis, como o etanol e o biodiesel. A transesterificação é mais um “novo conceito” abordado na química orgânica no ensino médio: trata-se da síntese do biodiesel, obtido a partir da reação de óleos vegetais (soja, babaçu, mamona), gorduras animais ou óleos residuais de fritura com etanol e catalisador.
\[\begin{align} &{{H}_{2}}C-O-CO-{{R}_{1}} \\ & \begin{matrix} {} & | \\ \end{matrix} \\ &HC-O-CO-{{R}_{2}}+3{{C}_{2}}{{H}_{5}}-OH\,\,\,\,\,\,\,\,\,\begin{matrix} NaOH \\ \rightleftharpoons \\ \end{matrix} \\ & \begin{matrix} {} & | \\ \end{matrix} \\ &{{H}_{2}}C-O-CO-{{R}_{3}} \\ \end{align}\]
\[\begin{align} &{{H}_{2}}C-OH\begin{matrix} {} & {} &{{R}_{1}}C{{O}_{2}}{{C}_{2}}{{H}_{5}} \\ \end{matrix} \\ & | \\ &HC-OH\,\begin{matrix} {} & {} &{{R}_{2}}C{{O}_{2}}{{C}_{2}}{{H}_{5}} \\ \end{matrix} \\ & | \\ &{{H}_{2}}C-OH\begin{matrix} {} & {} &{{R}_{3}}C{{O}_{2}}{{C}_{2}}{{H}_{5}} \\ \end{matrix} \\ & \\ & \begin{matrix} {} & {} &{} & \begin{matrix} \begin{matrix} \begin{matrix} {} & {} &{} \\ \end{matrix} & {} & {} \\ \end{matrix} & biodiesel\,B \\ \end{matrix} \\ \end{matrix} \\ \end{align}\]
Considerando que o biodiesel foi obtido a partir do óleo de soja, na reação de hidrólise desse biodiesel B, são obtidos como produtos o
(UEL - PR) Um grupo de substâncias orgânicas apresenta aromas agradáveis, estando presentes em frutas e flores. Industrialmente, a reação de esterificação de Fischer é um dos principais métodos para a síntese destas substâncias orgânicas empregadas como flavorizantes na confecção de balas, gelatinas, entre outros doces.
O flavorizante de morango, denominado etanoato de isobutila, é obtido em meio ácido a partir dos reagentes:
(UNIOESTE - PR) Na síntese industrial da procaína, são realizadas algumas transformações químicas, como mostrado no esquema abaixo.
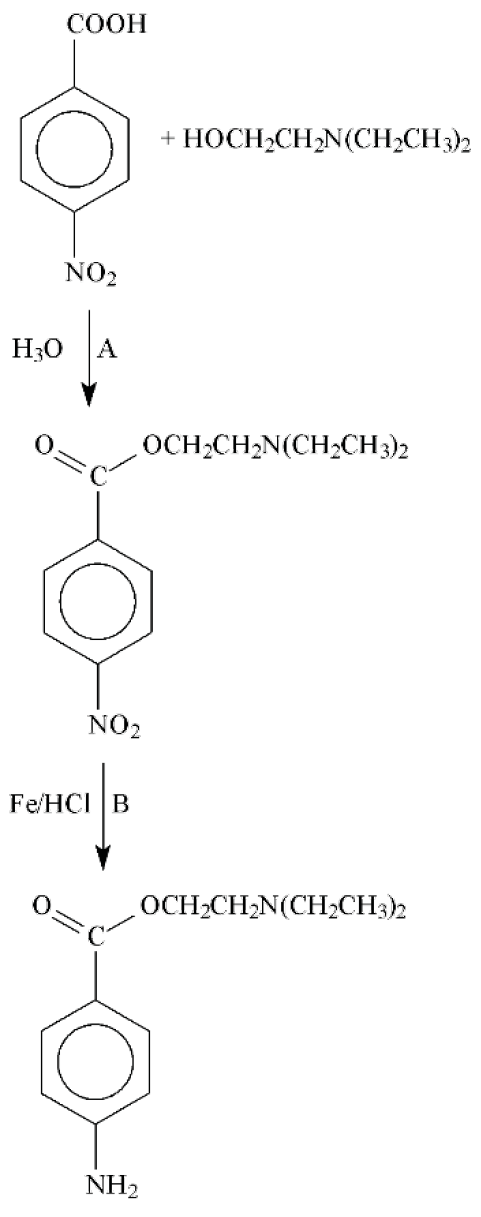
As etapas A e B assinaladas no esquema acima são, respectivamente, reações de
(UFPI - PI) O ácido linoleico (ômega-6) é considerado um alimento funcional, ou seja, alimento ou ingrediente que, além das funções nutricionais básicas, produz efeitos benéficos à saúde.
\[C{{H}_{3}}{{(C{{H}_{2}})}_{4}}\overset{\begin{smallmatrix} H \\ | \end{smallmatrix}}{\mathop{C}}\,=\overset{\begin{smallmatrix} H \\ | \end{smallmatrix}}{\mathop{C}}\,C{{H}_{2}}\overset{\begin{smallmatrix} H \\ | \end{smallmatrix}}{\mathop{C}}\,=\overset{\begin{smallmatrix} H \\ | \end{smallmatrix}}{\mathop{C}}\,{{(C{{H}_{2}})}_{7}}\overset{\begin{smallmatrix} O \\ \parallel \end{smallmatrix}}{\mathop{C}}\,-OH\]
As etapas A e B assinaladas no esquema acima são, respectivamente, reações de
(UEL - PR) A aspirina, medicamento usado como analgésico, antitérmico e anti-inflamatório, quando estocada durante um longo período de tempo, pode sofrer hidrólise na presença de água e calor. Nesta situação, o frasco contendo o medicamento
fora do prazo de validade apresenta odor igual ao do vinagre.Dado: Reação de hidrólise da aspirina
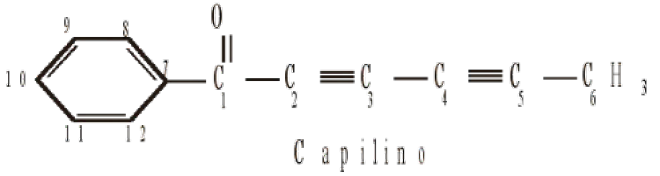
Com base no exposto, na equação química e nos conhecimentos sobre o tema, analise as afirmativas.
I. A hidrólise de uma molécula de aspirina produz 2 moléculas de ácidos carboxílicos.
II. O odor de vinagre no frasco é devido à formação do ácido acético.
III. O grupo \(^{-}OH\) está na posição “meta” na molécula do ácido salicílico.
IV. Os ácidos acético e salicílico são isômeros de cadeia.
Assinale a alternativa que contém todas as afirmativas corretas.
Você chegou ao fim dessa aula com sucesso!
Selecione o botão avançar para seguir para a próxima aula.