Considere dois sistemas:
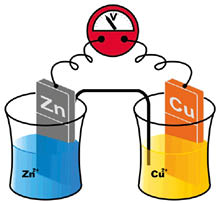
Mergulhando uma barra ou lâmina de um determinado metal em uma solução contendo íons desse metal, temos formado um eletrodo, que é o princípio necessário para estabelecermos uma pilha. Como exemplo, podemos citar uma barra de Cu mergulhada numa solução de \(CuS{{O}_{4}}\) (eletrodo de Cu, representado por \({{E}_{C{{u}^{2+}}/Cu}}\)), ou ainda uma lâmina de Zn, mergulhada numa solução de \(ZnS{{O}_{4}}\) (eletrodo de Zn, representado por \({{E}_{Z{{n}^{2+}}/Zn}}\)). Conforme foi relatado nos sistemas anteriormente explicitados, temos que \({{E}_{C{{u}^{2+}}/Cu}}>{{E}_{Z{{n}^{2+}}/Zn}}\). Se os potenciais de redução dos dois eletrodos são diferentes, entre eles haverá uma diferença de potencial (ddp) (ou força eletromotriz), condição necessária para a condução de corrente elétrica, caso façamos uma ligação entre estes eletrodos por um fio condutor. ddp= \({{E}_{red\,maior}}\,-{{E}_{red\,menor}}\) menor ou ddp=\({{E}_{oxi}}\,+{{E}_{red}}\).
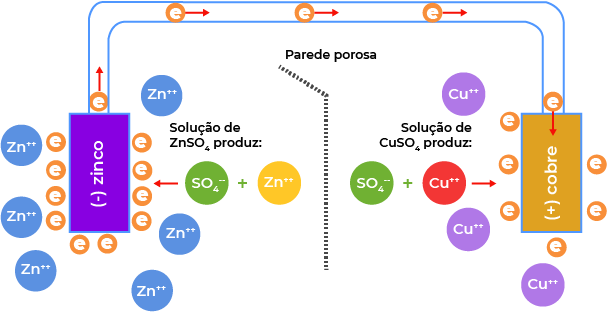
Ligando os dois eletrodos citados (de Cu e de Zn) por meio de um fio condutor, e estabelecendo uma ponte salina (gel contendo KCl) entre eles, haverá um circuito fechado para condução de corrente elétrica. Os elétrons se deslocam da lâmina de Zn para o eletrodo de Cu, assim, serão liberados cátions \(Z{{n}^{+}}\) no eletrodo de Zn. Os elétrons deslocados para o eletrodo de Cu farão com que se deposite sobre a lâmina Cu metálico (cátions que estavam em solução, recebendo elétrons). Dessa forma, o eletrodo de Zn fica com excesso de cátions, que serão equilibrados pelos ânions \(C{{l}^{-}}\) provindos da ponte salina, assim como o eletrodo de Cu ficará com excesso de \(S{{O}^{4-}}\), que serão equilibrados pelos cátions \({{K}^{+}}\) provindos da ponte salina). A pilha pode ser representada por \(Z{{n}_{(s)}}/Z{{n}^{2+}}_{(aq)}//C{{u}^{2+}}_{(aq)}/C{{u}_{(s)}}\). A reação global da pilha é dada por \(Z{{n}_{(s)}}+C{{u}^{2+}}_{(aq)\,} \to\, Z{{n}^{2+}}_{(aq)}+C{{u}_{(s)}}\).
Numa pilha, para saber se o funcionamento é espontâneo, devemos verificar se a espécie que recebe elétrons é a de \(>{{E}_{red}}\). Caso contrário, não será espontâneo.
Valores de \({{E}_{red}}\) em volts (solução aquosa 1M, 25 ºC) dos principais eletrodos utilizados
Existem no mercado alguns tipos de pilhas, como por exemplo a pilha comum usada em eletrônicos, chamada Pilha seca de Leclanché, baseada na reação
\[Z{{n}_{(s)}}+2Mn{{O}_{2(aq)}}+2N{{H}_{4}}{{^{1+}}_{(aq)\,}}\to\,Z{{n}^{2+}}_{(aq)}+1M{{n}_{2}}{{O}_{3(s)}}+2N{{H}_{3(g)}}\]
Nas pilhas alcalinas, o \(N{{H}_{4}}Cl\) é substituído por NaOH, e a reação global será
\[Zn(s)+2Mn{{O}_{2}}\,\to\,ZnO+M{{n}_{2}}{{O}_{3}}\]
As baterias de níquel cádmio foram muito utilizadas em celulares, com reação
\[1C{{d}_{(s)}}+2MiO(OH)+2{{H}_{2}}{{O}_{(\ell)\,}}\to \,1Cd{{(OH)}_{2(s)}}+2Ni{{(OH)}_{2}}_{(s)}\]
As baterias ácidas de chumbo são as utilizadas em carro, com reação
\[P{{b}_{(s)}}+Pb{{O}_{2(s)}}+2{{H}_{2}}S{{O}_{4(aq)\,}}\to\,2PbS{{O}_{4(s)}}+2{{H}_{2}}{{O}_{(l)}}\]
As baterias modernas de celulares e notebooks são chamadas íon Li, baseada na reação
\(L{{i}_{y}}{{C}_{6(s)\,}}\to\,6{{C}_{(s)}}+yL{{i}^{+}}_{(solv)}+y{{e}^{-}}\)
(UDESC) Analise a pilha \(F{{e}^{o}};\,F{{e}^{2+}}//C{{u}^{2+}};\,C{{u}^{o}}\), cujos potenciais-padrão de redução são:
\(\begin{align} &F{{e}^{2+}}+2{{e}^{-}}\,\to \,F{{e}^{o}}\,\,{{E}^{o}}\,\,=-0,44v \\ &C{{u}^{2+}}+2{{e}^{-}}\,\to \,C{{u}^{o}}\,\,{{E}^{o}}\,\,=-0,44v \\ \end{align}\)
A alternativa que indica ddp (ΔEº) para essa pilha é:
(UFPR - PR) Analise a figura da seguinte célula eletroquímica:
Considerando os potenciais-padrão de redução (Eº) : do cádmio – 0,402V e da prata +0,799V, é correto afirmar:
(UNESP – SP) Nas obturações dentárias, os dentistas não podem colocar em seus pacientes obturações de ouro e de amálgama muito próximas, porque os metais que constituem a amálgama (uma liga de prata, zinco, estanho, cobre e mercúrio) são todos mais eletropositivos que o ouro e acabariam transferindo elétrons para esse metal através da saliva, podendo levar à necrose da polpa dentária. Das semi-reações dos metais que constituem a amálgama, a que apresenta o metal mais reativo é:
(PUC – RJ) Um alquimista maluco descobriu que o chumbo metálico pode ceder elétrons espontaneamente em soluções de \(AuC{{l}_{3}}\), e construiu a seguinte pilha:
Para esta pilha, é correto afirmar:
\[\left|P{{b}^{o}} \right|\left. P{{b}^{2+}} \right|\,\,\left| A{{u}^{3+}} \right|\left.A{{u}^{o}} \right|\]
(PUC – MG) A proteção eletroquímica é uma forma de proteger um metal contra a corrosão. Ela consiste na utilização de um outro metal menos nobre que formará uma pilha com o metal a ser protegido. O metal mais nobre atuará como catodo da pilha e não será oxidado. Conhecendo-se os potenciais padrões de redução,
\(Z{{n}^{2+}}+2{{e}^{-}}\,\to\,Z{{n}_{(s)\,}}\,\,\,\,\,\,\,\,{{E}^{o}}=-0,76v \\ C{{u}^{+2}}+2{{e}^{-}}\,\to\,C{{u}_{(s)}}\,\,\,\,\,\,\,\,\,{{E}^{o}}=+0,34v\\ F{{e}^{+2}}+2{{e}^{-}}\,\to\,F{{e}_{(s)}}\,\,\,\,\,\,\,\,\,{{E}^{o}}=-0,44v\\ P{{b}^{2+}}+2{{e}^{-}}\,\to\,P{{b}_{(s)}}\,\,\,\,\,\,\,\,\,{{E}^{o}}=-0,13v\\ M{{g}^{+2}}+2{{e}^{-}}\,\to\,M{{g}_{(s)}}\,\,\,\,\,\,\,\,\,{{E}^{o}}=-2,37v\)
é CORRETO afirmar que o zinco pode ser protegido da corrosão utilizando:
(FGV) Numa pilha \(N{{i}^{o}}/N{{i}^{2+}}//A{{g}^{+}}/A{{g}^{o}}\), sabemos que o níquel cede elétrons para o eletrodo de prata e, daí, para os cátions prata \( (A{{g}^{+}})\). Logo:
(PUC) Na célula eletroquímica representada pela equação:
\[N{{i}^{o}}+2A{{g}^{+}}\,\to \,N{{i}^{2+}}+2A{{g}^{o}}\]
É correto afirmar que:
(UFMG - MG) A semi-equação: \({{H}_{2(g,1atm)}}\,\to\,2{{H}^{+}}_{(aq,1M)}+2{{e}^{-}}\,\,\,\,{{E}^{o}}=0,00\,volt\), representa:
(UNESP - SP)
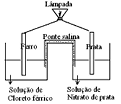
Quando o circuito do desenho é ligado, a lâmina de ferro é corroída e a de prata aumenta de massa. Sobre esse dispositivo, a afirmativa CORRETA é:
(ENEM) O boato de que os lacres das latas de alumínio teriam um alto valor comercial levou muitas pessoas a juntarem esse material na expectativa de ganhar dinheiro com sua venda. As empresas fabricantes de alumínio esclarecem que isso não passa de uma “lenda urbana”, pois ao retirar o anel da lata, dificulta-se a reciclagem do alumínio. Como a liga do qual é feito o anel contém alto teor de magnésio, se ele não estiver junto com a lata, fica mais fácil ocorrer a oxidação do alumínio no forno. A tabela apresenta as semirreações e os valores de potencial padrão de redução de alguns metais:
Com base no texto e na tabela, que metais poderiam entrar na composição do anel das latas com a mesma função do magnésio, ou seja, proteger o alumínio da oxidação nos fornos e não deixar diminuir o rendimento da sua reciclagem?
(UFGO – GO) Muitos dos termos que os químicos utilizam, tais como ânion, cátion, eletrodo e eletrólito, foram introduzidos por M. Faraday, um pesquisador bastante influente na história da Química. Sobre estes termos, é correto afirmar:
(FUC – MT) Nas pilhas eletroquímicas obtém-se corrente elétrica devido à reação de oxidorredução.
Podemos afirmar que:
(UEM – PR) Considere uma célula eletroquímica montada com os elementos a seguir, com seus respectivos potenciais-padrão de redução (em Volts) e assinale a(s) alternativa(s) correta(s).
\(\begin{align} &{{J}^{2+}}+2{{e}^{-}}\,\rightleftharpoons{{J}^{0}}\,\,\,\,\,\,\,\,{{E}^{0}}=-0,44 \\ &{{G}_{2}}+2{{e}^{-}}\,\rightleftharpoons \,2{{G}^{-}}\,\,\,\,\,{{E}^{0}}=+2,87\\ \end{align}\)
(UECE) A água é o principal componente do sangue. Não é à toa que profissionais de saúde aconselham que se beba 8 copos de água por dia. Assim, quanto mais água ingerida, mais líquido vermelho corre nas veias. Isso aumenta o transporte de nutrientes por todo o corpo, inclusive para o cérebro, que tem suas funções otimizadas. Isso se dá não só porque o cérebro recebe mais nutrientes por meio do sangue, mas também porque certas reações químicas que acontecem nele, entre elas, a formação da memória, também dependem da presença da água para acontecer. A água atua como agente oxidante na seguinte equação:
(UEM – PR) Considerando os dados da tabela abaixo, assinale o que for correto.
(UECE) Segundo o INMETRO, a pilha alcalina produz voltagem de 1,5 V, não é recarregável, mantém a voltagem constante por mais tempo e, embora custe mais caro, dura cerca de cinco vezes mais. Seu nome decorre do fato de ela substituir a pasta de cloreto de amônio e cloreto de zinco por hidróxido de potássio ou hidróxido de sódio. Considerando a reação que ocorre na pilha alcalina.
\(Zn+2Mn{{O}_{2}}+{{H}_{2}}O\,\to\,Z{{n}_{2}}++M{{n}_{2}}{{O}_{3}}+2OH\)
Pode-se afirmar corretamente que sua duração é maior porque
(UNESP - SP) o ciclo do enxofre é fundamental para os solos dos manguezais. Na fase anaeróbica, bactérias reduzem o sulfato para produzir o gás sulfeto de hidrogênio. Os processos que ocorrem são os seguintes:
Na produção de sulfeto de hidrogênio por esses processos nos manguezais, o número de oxidação do elemento enxofre
(UEM – PR) Considere a célula eletrolítica representada a seguir.
\(A{{g}^{+}}\left|Ag\,\,\,E{}^\text{o}=0,80v\,\,\,\,\,\,C{{u}^{2+}}\left| Cu\right.\,\,\,E{}^\text{o}=0,34v \right.\)
Com base nas informações contidas na figura, estão corretas as proposições:
(UEPG – PR) A galvanização é um processo de proteção do ferro ou do aço através de um revestimento com zinco metálico, que atua como uma fina película para evitar corrosão ou ferrugem. Considerando as equações e os potenciais abaixo, assinale o que for correto.
\[\begin{align} &F{{e}^{2+}}+2{{e}^{-\,}}\,\to \,F{{e}_{(s)\,}}\,\,{{E}^{o}}red=-0,44v \\ &Z{{n}^{2+}}+2{{e}^{-\,}}\,\to \,Z{{n}_{(s)\,}}\,\,{{E}^{o}}red=-0,76v \\ \end{align}\]
(UNIRIO)
\(F{{e}^{2+}}_{(aq)}+2{{e}^{-}}\,\to\,F{{e}_{(s)}}\,\,\,\,{{E}^{o}}=-0,44v\)
\(C{{d}^{2+}}_{(aq)}+2{{e}^{-}}\,\to\,C{{d}_{(s)}}\,\,\,\,{{E}^{o}}=-0,40v\)
\(N{{i}^{2+}}_{(aq)}+2{{e}^{-}}\,\to\,N{{i}_{(s)}}\,\,\,\,{{E}^{o}}=-0,25v\)
\(C{{u}^{2+}}_{(aq)}+2{{e}^{-}}\,\to\,C{{u}_{(s)}}\,\,\,\,{{E}^{o}}=+0,34v\)
Indique a opção que contém a pilha com a maior diferença de potencial, de acordo com a tabela de potenciais-padrão em solução aquosa, a 25 °C, apresentada acima.
(UFAC - AC) Cientistas criam bateria com urina! (folha online 16/08/2005). A bateria é feita de uma camada de papel empapado em cloreto de cobre, que depois é colocado entre tiras de magnésio e cobre. O aparelho mede 6 x 3 centímetros e tem apenas 1 milímetro de espessura. O equipamento é mergulhado em urina e, assim, passa a conduzir eletricidade. Com base nestas informações, analise as afirmativas a seguir, e, após, marque a alternativa correta.
I. As tiras de magnésio funcionam como anodo.
II. O cobre sofre redução.
III. A urina tem papel de ponte salina, permitindo o fluxo de íons pelo sistema.
(UFBA - BA) A figura abaixo representa uma pilha de combustível hidrogênio-oxigênio, muito utilizada em veículos espaciais. Esse tipo de pilha tem por base as semirreações apresentadas na tabela a seguir.
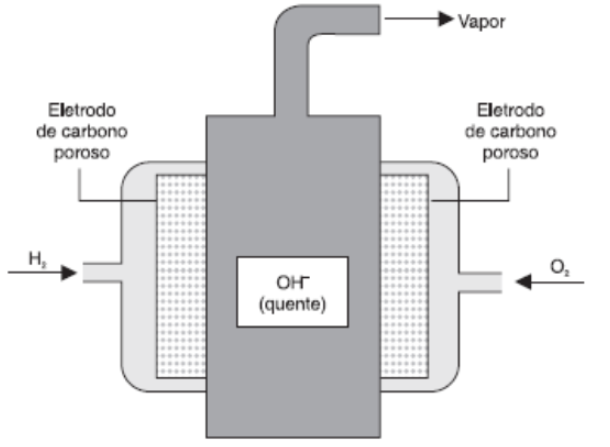
Considerando-se essas informações, pode-se afirmar:
(MACKENZIE – SP) Para retardar a corrosão de um encanamento de ferro, pode-se liga-lo a um outro metal, chamado de metal de sacrifício, que tem a finalidade de se oxidar antes do ferro. Conhecendo o potencial padrão de redução, pode-se dizer que o melhor metal para atuar como metal de sacrifício é:
(UEPG) Considere a seguinte ordem crescente de reatividade e assinale o que for correto.
Au < Pt < Ag < Hg < Cu < H < Pb < Sn < Ni < Fe < Cr < Zn
(UEPG - PR) Entre as pilhas comerciais, encontram-se as chamadas pilhas secas, como as de zinco-carvão ou de Leclanché, usadas em lanternas, rádios e gravadores. A parede desse tipo de pilha é feita de zinco, de onde os elétrons migram através do circuito até um bastão de grafite, existente no centro, recoberto por uma mistura de dióxido de manganês e carvão em pó. Uma pasta úmida constituída de cloreto de amônio \((N{{H}_{4}}Cl)\), cloreto de zinco,\((ZnC{{l}_{2}})\) em meio aquoso, completa o sistema.
Com base nessa descrição, assinale o que for correto.
(ITA - SP) Dois copos (A e B) contêm solução aquosa 1 \(mol{{L}^{-1}}\) em nitrato de prata e estão conectados entre si por uma ponte salina. Mergulha-se parcialmente um fio de prata na solução contida no copo A, conectando-o a um fio de cobre mergulhado parcialmente na solução contida no copo B. Após certo período de tempo, os dois fios são desconectados. A seguir, o condutor metálico do copo A é conectado a um dos terminais de um multímetro, e o condutor metálico do copo B, ao outro terminal.
Admitindo que a corrente elétrica não circula pelo elemento galvânico e que a temperatura permanece constante, assinale a opção que contém o gráfico que melhor representa a forma como a diferença de potencial entre os dois eletrodos \((\Delta E={{E}_{A}}-{{E}_{B}})\) varia com o tempo.
(ITA - SP) Um elemento galvânico é constituído pelos eletrodos abaixo especificados, ligados por uma ponte salina e conectados a um multímetro de alta impedância.
Eletrodo a: Placa de chumbo metálico mergulhada em uma solução aquosa 1 \(mol{{L}^{-1}}\) de nitrato de chumbo.
Eletrodo b: Placa de níquel metálico mergulhada em uma solução aquosa 1 \(mol{{L}^{-1}}\) de sulfato de níquel.
Após estabelecido o equilíbrio químico nas condições-padrão, determina-se a polaridade dos eletrodos. A seguir, são adicionadas pequenas porções de KI sólido ao Eletrodo a, até que ocorra a inversão de polaridade do elemento galvânico.
Dados eventualmente necessários:
Produto de solubilidade de \(Pb{{l}_{2}}:{{K}_{PS}}(Pbl{{\,}_{2}})=8,5\times{{10}^{-9}}\)
Potenciais de eletrodo em relação ao eletrodo padrão de hidrogênio nas condições-padrão:
\(\begin{align} &E_{Pb/P{{b}^{2+}}}^{o}=-0,13v\,\,\, \\ &E_{Ni/N{{i}^{2+}}}^{o}=-0,25v\,\, \\ &\,E_{{{I}^{-}}/{{I}_{2}}}^{o}=0,53v \\ \end{align}\)
Assinale a opção que indica a concentração CORRETA de KI, em \(mol{{L}^{-1}}\), a partir da qual se observa a inversão de polaridade dos eletrodos nas condições-padrão.
(FUVEST - SP) Recentemente, foi lançado no mercado um tira-manchas, cujo componente ativo é \(2N{{a}_{2}}C{{O}_{3}}\cdot3{{H}_{2}}{{O}_{2}}\). Este, ao se dissolver em água, libera peróxido de hidrogênio, que atua sobre as manchas.
(FUVEST - SP) Uma mistura de cloreto de sódio e nitrato de sódio, de massa 20,20 g, foi dissolvida em água suficiente. A essa solução adicionaram-se 250 mL de solução aquosa de nitrato de prata de concentração 0,880 mol/L. Separou-se o sólido formado, por filtração, e no filtrado mergulhou-se uma placa de cobre metálico de massa igual a 20,00 g. Após certo tempo, observou-se depósito prateado sobre a placa e coloração azul na solução. A placa seca pesou 21,52 g.
O esquema desse procedimento é:
Dados: massas molares (g/mol)
Ag.....108
Cu.....64
NaCl.....58
(UFBA - BA) Uma scooter movida a célula de combustível foi uma das atrações da Feira Industrial de Hannover, na Alemanha. [...] O veículo é equipado com várias soluções para célula de combustível [...] incluindo placas bipolares, vedações, trocadores de calor, bombas elétricas de água e válvulas. (SCOOTER.... In: A TARDE, 2004, p. 5).
A célula de combustível de hidrogênio-oxigênio constitui um meio de gerar e estocar energia elétrica de forma contínua, com eficiência próxima a 100%, enquanto o abastecimento de combustível for mantido. O ânodo e o cátodo dessa célula são confeccionados à base de níquel poroso, e o eletrólito é o hidróxido de potássio, KOH, em solução aquosa concentrada.
O funcionamento dessa célula pode ser compreendido, a partir da análise dos dados apresentados na tabela.
Você chegou ao fim dessa aula com sucesso!
Selecione o botão avançar para seguir para a próxima aula.