Dada a dissociação ou ionização da substância AB em meio aquoso \(AB\leftrightarrow \,{{A}^{+}}+{{B}^{-}}\), temos que tal reação é um fenômeno reversível, sendo assim, após determinado tempo será atingido o equilíbrio químico (ou neste caso, equilíbrio iônico). O equilíbrio iônico não pode ser tratado em termos de sais solúveis ou bases fortes, visto que estas dissociações não são reversíveis.
Considerando a ionização \(HCl\leftrightarrow \,{{H}^{+}}+C{{l}^{-}}\), o equilíbrio pode ser dado por \(Ka=\frac{[{{H}^{+}}]\cdot[C{{l}^{-}}]}{[HCl]}\), onde \({{K}_{a}}\) é a constante de ionização (ou \({{K}_{b}}\), no caso de bases).
É importante lembrar que \({{K}_{a}}\) é influenciada pela temperatura, e que em casos onde há mais de uma etapa de ionização (como ácidos polipróticos), temos uma constante de ionização para cada etapa. Ainda, a \({{K}_{a}}\) da primeira etapa de ionização será superior a \({{K}_{a}}\) da segunda etapa de ionização, e assim sucessivamente.
Se temos o grau de dissociação de um eletrólito com concentração molar (ɱ) dado por α = quantidade de mols ionizados/quantidade inicial de mols dissolvidos, podemos relacionar , por onde podemos prever que quanto menor a concentração de uma solução, maior seu grau de ionização. Para eletrólitos fracos, onde α é muito baixo, temos que \({{K}_{a}}=m\,.\,{{\alpha}^{2}}\).

É a aplicação do princípio de Le Chatelier (deslocamento de equilíbrio), ao equilíbrio iônico. Consideremos duas situações:
São substâncias que mudam de cor dependendo da acidez ou basicidade do meio em que se encontram. Essa alteração da cor decorre da alteração do equilíbrio químico de dissociação dessa substância indicadora. Como exemplo, podemos citar a fenolftaleína, um ácido fraco que quando não ionizado, é incolor, já quando ionizado, apresenta coloração rosa. Isso ocorre porque na presença de uma substância básica, os íons \(O{{H}^{-}}\) provenientes da base se ligam aos íons \({{H}^{+}}\) provenientes da dissociação do indicador, deslocando o equilíbrio para o sentido da dissociação do indicador, que apresentará coloração rosa.
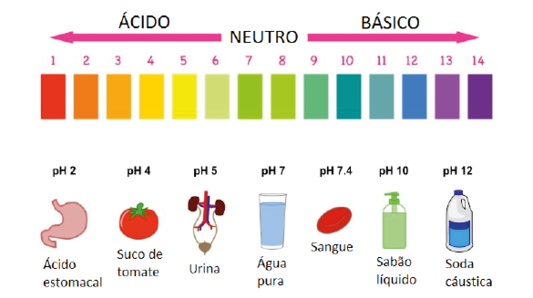
O equilíbrio iônico da água pode ser dado por \({{H}_{2}}O\,\leftrightarrow {{H}^{+}}+O{{H}^{-}}\) ou ainda por \(N{{H}_{4}}OH\,\leftrightarrow N{{H}_{4}}^{+}+O{{H}^{-}}\). Como o grau de ionização da água é muito baixo em relação ao número total de moléculas, podemos propor o produto iônico da água dado por \({{K}_{w}}=[{{H}^{+}}]\,.\,[O{{H}^{-}}]={{10}^{-7}}\). Em meio ácido \([{{H}^{+}}]\,>[O{{H}^{-}}]\), ou ainda \([{{H}^{+}}]\,>{{10}^{-7}}mol/L\). Em meio básico \([{{H}^{+}}]\,<[O{{H}^{-}}]\), ou ainda \([{{H}^{+}}]\,<{{10}^{-7}}mol/L\).
As escalas de potencial hidrogeniônico(pH) ou potencial hidroxiliônico (pOH) são usadas em vistas de se evitar as potências negativas do produto de ionização da água. São dadas por \(pH=-\log[{{H}^{+}}]\) e \(pOH=-\log[{{H}^{-}}]\).
Assim, temos: soluções ácidas, pH<7 e para soluções básicas, pH>7.
pH+pOH=14 e \(pH=-\log\, {{10}^{-x}}=x\).
Se considerarmos um sal pouco solúvel com equilíbrio dado por \({{A}_{a}}\,{{B}_{b}}\,\leftrightarrow a{{A}^{+}}+b{{B}^{-}}\), temos a constante de equilíbrio, também chamada de produto de solubilidade, dada por \({{K}_{ps}}={{[{{A}^{+}}]}^{a}}\,.\,\,{{[{{B}^{-}}]}^{b}}\). Esta expressão é aplicada apenas para soluções saturadas de eletrólitos insolúveis ou pouco solúveis.
Ainda, é importante lembrar que \({{K}_{ps}}\) é influenciado pela temperatura, e que quanto mais solúvel o eletrólito, maior o valor de \({{K}_{ps}}\).
(OSEC – SP) São dadas as constantes de ionização do ácido acético (\(C{{H}_{3}}COOH\)) e do ácido hipocloroso (HClO), as quais valem, respectivamente, \(1,8\,\times \,{{10}^{-5}}\) e \(3,5\,\times\,{{10}^{-8}}\). A partir destes dados, podemos concluir que:
(OSEC – SP) Sabendo-se que o grau de ionização (α) de uma solução 0,1 molar de ácido acético a 25° C é \(1,35\,\times\,{{10}^{-2}}\), podemos concluir que a constante de ionização do ácido acético, na mesma temperatura é:
(PUCCAMP – SP) Para aumentar efetivamente a concentração de
íons carbonato no equilíbrio:
\[HCO_{3}^{-}+O{{H}^{-}}\,\rightleftarrows\,{{H}_{2}}O+CO_{3}^{-}\]
dever-se-ia adicionar:
(UFJF) Em uma garrafa de refrigerante, ou cerveja, há pelo menos uma reação química reversível ocorrendo a todo o tempo: a decomposição do ácido carbônico em meio aquoso, como mostra a equação química abaixo:
\[{{H}_{2}}C{{O}_{3(aq)}}\,\rightleftarrows\,{{H}_{2}}{{O}_{(\ell )}}+C{{O}_{2(g)\,}}\,\,\Delta H>0\]
Segundo o Princípio de Le Chatelier, quando a garrafa é aberta, ocorre:
(UEL – PR) Uma parte do \(C{{O}_{2}}\) formado durante o processo da respiração dissolve-se no sangue e é um dos componentes responsáveis pela constância de seu pH. Entretanto, a perda ou o acúmulo excessivo de CO2 no sangue pode provocar uma pequena variação em seu pH.
Considere, a uma dada temperatura, a seguinte reação e a sua respectiva constante de equilíbrio:
\[C{{O}_{2(g)}}+\,{{H}_{2}}O\,\rightleftarrows \,{{H}^{+}}(aq)+HC{{O}_{3}}^{-}(aq)\,\,\,K[{{H}^{+}}]\,[HC{{O}_{3}}^{-}]\,/\,[C{{O}_{2}}]\]
Com base nessas informações, é correto afirmar:
(UFRN – RN) A concentração de \(C{{O}_{2}}\) na atmosfera vem aumentando nos últimos anos. Segundo os cientistas, o aumento da quantidade desse gás que é dissolvida no oceano pode prejudicar particularmente os corais e as espécies que têm conchas duras.
O equilíbrio do \(C{{O}_{2}}\) em solução aquosa pode ser representado pelas seguintes etapas:
\[\begin{align} &C{{O}_{2}}_{(g)}\,\rightleftarrows\,C{{O}_{2}}_{(aq)}\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,(1)\\ &C{{O}_{2}}_{(aq)}\,+{{H}_{2}}O(l)\rightleftarrows \,{{H}_{2}}C{{O}_{3}}_{(aq)}\,\,\,\,\,\,\,\,\,\,\,(2)\\ &{{H}_{2}}C{{O}_{3}}\rightleftarrows\,HCO{{_{3}^{-}}_{(aq)}}+{{H}^{+}}_{(aq)}\,\,\,\,\,\,\,\,\,\,\,\,\,(3) \\ \end{align}\]
A dissolução do \(C{{O}_{2}}\) no oceano provoca
(PUC – RS) Considere o equilíbrio químico que se estabelece em uma solução aquosa de ácido acético que pode ser representado pela equação: \(C{{H}_{3}}COO{{H}_{(aq)}}\,\rightleftarrows\,C{{H}_{3}}COO{{H}^{-}}_{(aq)}+{{H}^{+}}_{(aq)}\)
Mantendo-se constante a temperatura e adicionando-se uma solução aquosa de acetato de sódio, de fórmula \(C{{H}_{3}}COOHNa\), é incorreto afirmar que
(FATEC) A amônia \((N{{H}_{3}})\), molécula de estrutura semelhante à da fosfina, reage com água produzindo uma solução de caráter básico. A reação que ocorre pode ser representada pela equação química.
\[N{{H}_{3(g)}}+{{H}_{2}}{{O}_{(\ell)}}\,\rightleftarrows \,NH_{4(aq)}^{+}+OH_{(aq)}^{-}\]
Uma solução aquosa de \(N{{H}_{3}}\) apresenta concentração inicial de 0,02 mol/L a 25 °C.
Nessas condições, o valor da concentração de íons \(O{{H}^{-}}\), em mol/L, é
(Dado: Constante de basicidade de amônia a 25 °C: Kb = \(1,8\,\times\,{{10}^{-5}}\))
(USP – SP) Juntando-se cloreto de sódio a uma solução diluída de ácido clorídrico, o pH da solução:
(PUC – RJ) O produto de solubilidade do AgCl é \(1,8\,\times\,{{10}^{-10}}\) a 298 K. Assinale a opção que indica a concentração de íons \(A{{g}^{+}}\), que se obtém no equilíbrio, quando se adiciona um excesso de AgCl em uma solução 0,1 M de NaCl.
(UFTM – MG) Observe a tabela que considera volumes iguais de quatro soluções aquosas de ácidos com mesma concentração em quantidade de matéria \((MOL.{{l}^{-1}})\) e valores aproximados da constante de equilíbrio \(({{K}_{a}})\).
Sobre essas soluções, pode-se afirmar que:
(UFPR – PR) O vinagre, conhecido desde a Antiguidade, é uma solução de aproximadamente 4 a 8% de ácido acético, resultante da ação de microrganismos sobre bebidas alcoólicas, como o vinho, em presença de oxigênio. Por volta de 218 a.C., o general cartaginês Aníbal, no comando de um exército, atravessou os Alpes em 15 dias, surpreendendo os romanos. Segundo relatos, Aníbal teria utilizado vinagre para fragmentar rochas que bloqueavam o caminho. Para tal, seria necessária uma enorme quantidade dessa solução e um período muito maior que os 15 dias para obter os efeitos desejados. Embora seja pouco provável a veracidade do relato, ele pode estar associado à ação do vinagre sobre rochas calcárias, representada pelas equações abaixo, não balanceadas:
\[\begin{align} &C{{H}^{3}}COO{{H}_{(aq)\,}}D\,{{H}^{+}}_{(aq)}+C{{H}_{3}}CO{{O}^{-}}_{(aq)}\,\,\,Ka=1,8\,.\,{{10}^{-5}}\\ &{{H}^{+}}_{(aq)}+CaC{{O}_{3(s)}}\,D\,C{{a}^{2+}}_{(aq)}+{{H}_{2}}O(liq)+C{{O}_{2(g)}}\\ \end{align}\]
Dados: massa molar do ácido acético = 60 g e do carbonato de cálcio = 100 g
Com relação às informações acima, é correto afirmar:
(ITA - SP) Numa solução aquosa 0,100 mol/L de um ácido monocarboxílico, a 25ºC, o ácido está 3,7% dissociado após o equilíbrio ter sido atingido. Assinale a opção que contém o valor correto da consante de dissociação desse ácido nesta temperatura.
(UFMS - MS) Muitas reações químicas, feitas em determinadas condições, são reversíveis, ou seja, ao mesmo tempo em que as substâncias reagentes se transformam em produtos, os produtos reagem entre si reconstituindo os reagentes. A respeito dos equilíbrios químicos, assinale a(s) proposição(ões) correta(s).
(UFMS – MS) O ácido fosfórico puro, \({{H}_{3}}P{{O}_{4(s)}}\), é um sólido incolor e cristalino. Em solução aquosa a 85%, em peso, dá origem a um líquido oleoso, usado na preparação de fertilizantes e de restaurações dentárias, bem como acidulante em bebidas refrigerantes. Esse ácido, em solução aquosa a 25 ºC, apresenta três constantes de ionização, cujos valores são:
\[4,7\,\times\,{{10}^{-13}}\,mol/L,\,\,\,7,1\,\times\,{{10}^{-3}}\,mol/L\,\,e\,\,6,3\,\times \,{{10}^{-8}}\,mol/L.\]
A respeito do ácido fosfórico aquoso 0,10 mol/L, a 25ºC, é correto afirmar que
(ITA - SP) Um indicador ácido-base monoprótico tem cor vermelha em meio ácido e cor laranja em meio básico. Considere que a constante de dissociação desse indicador seja igual a \(8,0\,\times \,{{10}^{-5}}\).
Assinale a opção que indica a quantidade, em mols, do indicador que, quando adicionada a 1 L de água pura, seja suficiente para que 80% de suas moléculas apresentem a cor vermelha após alcançar o equilíbrio químico.
(UFMS – MS) Adicionou-se um ácido HA a um balão volumétrico de 100mL, contendo 50% do volume em água destilada. Uma vez completado o volume do balão com água destilada, observou-se que parte do ácido adicionado se encontrava ionizado e que, no equilíbrio formado, havia 0,1 mol/L de ácido e \(3,0\,\times\,{{10}^{-3}}\,mol/L\) de íons \({{H}^{+}}\). A respeito desse equilíbrio, assinale a(s) proposição(ões) correta(s).
(Dados: log 3 = 0,477 e log 0,1 = 1)
(UFPR – PR) Os sais de bário, especialmente o sulfato de bário, quando aplicados por via oral e devido à sua baixa solubilidade \((Kps=1\times\,{{10}^{-10}})\), aumentam o contraste para os raios-X, no diagnóstico médico do sistema digestivo. Considerando-se que foram reagidos \(7\times\,{{10}^{-5}}\) moles de \(BaC{{l}_{2}}\) com quantidade equivalente de \(N{{a}_{2}}S{{O}_{4}}\), em água destilada suficiente para completar 1000 mL, calcule a massa de \(BaS{{O}_{4}}\) produzida, se o precipitado for filtrado e secado.
Massas atômicas: Ba = 137; S = 32; Na = 23; O =16; Cl = 35,5.
(UFBA – BA) O “sangue do diabo” é um líquido vermelho que, quando derramado sobre a roupa, se descora após certo tempo. Ele é preparado pela adição do indicador fenolftaleína a uma solução de amônia em água.
A respeito dessa solução, assinale o que for correto.
(UFRGS) Considere as seguintes afirmações sobre o comportamento de ácidos em solução aquosa.
I. O grau de ionização de um ácido fraco, como o ácido acético, aumenta com o aumento da diluição.
II. A maior concentração de um ácido forte acarreta maior grau de ionização e maior constante de ionização.
III. A segunda constante de ionização de um ácido poliprótico é sempre menor que a primeira constante.
Quais estão corretas?
(UFMS – MS) Considerando que a ionização do ácido acético, CH3COOH, em meio aquoso, é insignificante em relação às suas moléculas não-ionizadas, e sabendo-se que a 25°C ele apresenta \(Ka=1,8\,\times \,{{10}^{-5}}\), é correto afirmar que:
(UEPG – PR) A enzima anidrase carbônica, que catalisa a reação representada abaixo, está envolvida no controle do equilíbrio ácido-básico do sangue e da velocidade da respiração. Sobre este assunto, assinale o que for correto.
\[{{H}_{2}}O+C{{O}_{2}} \overset {anidrase\,carbônica} {\leftrightarrows}{{H}_{2}}C{{O}_{3}} \rightleftharpoons HCO_{3}^{-}+{{H}^{+}}\]
(UNIFOR – CE) A niacina (ácido nicotínico) é uma vitamina do complexo B.
Sua deficiência causa doenças da pele e do sistema nervoso.
Dissolvida em água, produz solução com pH < 7, a 25 ºC.
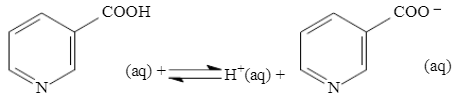
Para uma solução \(2,0 \times {{10}^{-3}}\) de niacina a \([H_{(aq)}^{+}]=5,5 \times {{10}^{-4}}mol/L\). Com esse dado pode-se calcular o valor da constante do equilíbrio apresentado. Seu valor é igual a
(UERJ) O cianeto de hidrogênio (HCN) é um gás extremamente tóxico, que sofre ionização ao ser dissolvido em água, conforme a reação abaixo.
\[N{{H}_{(aq)}} \rightleftarrows H_{(aq)}^{+}+CN_{(aq)}^{-}\]
Em um experimento, preparou-se uma solução aquosa de HCN na concentração de 0,1 mol.L-1 e grau de ionização igual a 0,5%. A concentração de íons cianeto nessa solução, em \(mol.{{L}^{-1}}\), é igual a:
(ITA – SP) Assinale a afirmação INCORRETA relativa à comparação das duas soluções aquosas seguintes: a primeira foi preparada dissolvendo-se 1,0 mol de ácido forte (HX) em 1 litro de água; a segunda, dissolvendo-se em 1 litro de água 1,0 mol de ácido fraco (AH) com constante de dissociação da ordem de \({{10}^{-6}}\).
(MACKENZIE – SP) Sejam os equilíbrios aquosos e suas constantes de ionização a 25ºC:
\[\begin{align} &HF\rightleftarrows{{H}^{+}}+{{F}^{-\,}}\,\,\,\,\,\,\,\,\,\,\,\,\,\,{{K}_{1}}={{10}^{-4}} \\ &HA\rightleftarrows{{H}^{+}}+{{A}^{-}}\,\,\,\,\,\,\,\,\,\,\,\,\,{{K}_{2}}={{10}^{-5}} \\ &HF+{{A}^{-}}\rightleftarrows HA+{{F}^{-}} \\ \end{align}\]
O valor da constante de equilíbrio da reação abaixo, vale:
(VUNESP) Fosfato de cálcio, \(C{{a}_{3}}{{(P{{O}_{4}})}_{2}}\), é um dos principais constituintes dos cálculos renais (“pedras nos rins”). Esse composto precipita e se acumula nos rins. A concentração média de íons \(C{{a}^{2+}}\) excretados na urina é igual a \(2\,.\,{{10}^{-3}}\,mol/L\). Calcule a concentração de íons \(P{{O}_{4}}^{3-}\) que deve estar presente na urina, acima da qual começa a precipitar fosfato de cálcio. Produto de solubilidade de \(C{{a}_{3}}{{(P{{O}_{4}})}_{2}}=1\,.\,{{10}^{-25}}\). \({{10}^{-25}}\). Massas atômicas: Ca = 40; P = 31; O = 1
(UFF) Uma solução de ácido acético 0,050 M apresenta um grau de dissociação (α) 0,4 % à temperatura de 25ºC.
Para esta solução, à temperatura mencionada, calcule:
Dado: log 2 = 0,301
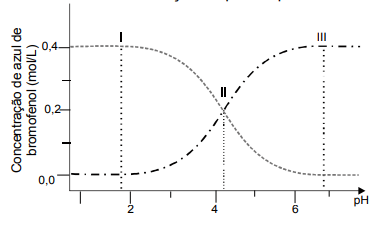
(UFG) De acordo com um estudo de indicadores ácido-base (Quim. Nova, 2006, 29, 600), o equilíbrio ácido-base do corante azul de bromofenol pode ser representado por
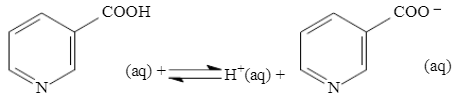
e o perfil da concentração desse corante em função do pH é representado no gráfico abaixo.
(UFF) O Sulfeto de hidrogênio, \({{H}_{2}}S\), é um gás de odor desagradável, produzido pela decomposição anaeróbia de compostos orgânicos. Quando dissolvido em água, o \({{H}_{2}}S\) comporta-se como um diácido fraco. Escreva as equações químicas representativas das etapas de ionização do \({{H}_{2}}S\) na água, a expressão da constante de ionização (Ka), para cada uma dessas etapas e a relação de grandeza existente entre essas constantes de ionização.
Você chegou ao fim dessa aula com sucesso!
Selecione o botão avançar para seguir para a próxima aula.