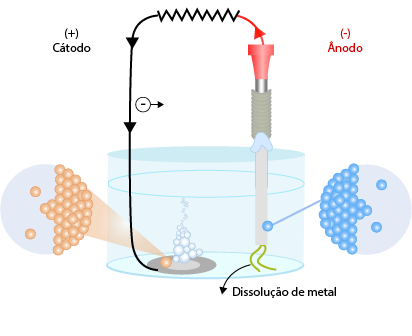
É uma reação de oxirredução não espontânea, ou seja, funciona da maneira inversa a uma pilha, necessitando assim de uma fonte externa de corrente elétrica. Ao recipiente onde se processa a eletrólise, denominamos célula ou cuba eletrolítica. Já a substância que conduz corrente elétrica (eletrólito) deve ser um composto iônico em solução ou fundido. Ainda, pode ser um composto molecular, contanto que este se ionize em solução (como por exemplo os ácidos).
No sistema de eletrólise, teremos o polo positivo (ânodo), que sofre oxidação, ou seja, perde elétrons. Estes elétrons são transportados pelo circuito externo em direção ao polo negativo (cátodo), onde serão recebidos pelos íons positivos. Como a reação é não espontânea, é necessário que a ddp fornecida seja superior a reação da pilha.
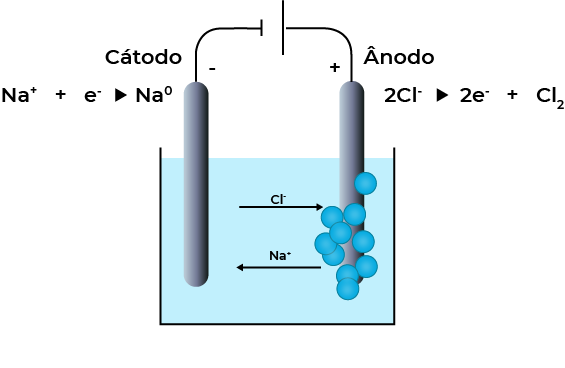
É aquela que ocorre tendo como eletrólito um composto iônico fundido, para que assim haja íons no sistema. Como exemplo podemos citar a eletrólise ígnea em NaCl, fundido, onde normalmente os eletrodos usados são de grafite.
Ânodo: \(2C{{l}^{-}}\,\,\to \,C{{l}_{2(g)}}+{{2}^{-}}\)
Cátodo: \(2N{{a}^{+}}+2{{e}^{-}}\to 2Na\)
Reação global: \(2C{{l}^{-}}+2N{{a}^{+}}\to C{{l}_{2(g)}}+2N{{a}_{(s)}}\)
É aquela que ocorre tendo como eletrólito uma solução de água contendo uma substância dissociada ou ionizada. Dessa forma, teremos não apenas os íons provenientes da substância dissolvida, mas também os íons da própria água. Na eletrólise aquosa, primeiramente apenas um tipo de cátion é atraído pelo cátodo, e só na ausência deste, ocorrerá a atração do cátion demais. O mesmo comportamento se observa em relação aos ânions. Assim, deve-se verificar dentro os ânions presentes, aquele que apresenta maior eletronegatividade, que será o primeiro tipo de ânion a descarregar os elétrons. De forma geral, a ordem de eletronegatividade dos ânions será \({{F}^{-}}\), ânions oxigenados, \(O{{H}^{-}}\), ânions orgânicos, demais ânions. Já a ordem de facilidade de descarga dos cátions será \(l{{A}^{+}},\,ll{{A}^{2+}},\,\,A{{l}^{3+}},\,\,{{H}^{+}}\), cátions restantes.
Os elétrons que atravessam o circuito transportam uma carga de \(1,6\,\cdot\,{{10}^{-19}}\) coulomb (C) por elétron. Assim, para um mol de elétrons, teremos uma carga de 96500 C (corresponde a 1 Faraday, F). A carga que atravessa um circuito pode também ser dada por Q(coulombs)=corrente (i, em ampères) x tempo (t, em segundos).
\[m=K1\,\cdot\,Q\]
m = massa da substância
k = constante de proporcionalidade
Q = carga elétrica (Coulomb)
“Empregando-se a mesma quantidade de carga elétrica (Q), em diversos eletrólitos, a massa da substância eletrolisada, em qualquer dos eletrodos, é diretamente proporcional ao equivalente-grama da substância.“
\[m=K2\,\cdot\,E\]
m = massa da substância (g)
\({{K}_{2}}\) = constante de proporcionalidade
E = equivalente-grama
Unindo as duas leis, temos:
\[m=K\cdot E\cdot Q\]
Estudamos na Física que:
\[Q=i\cdot t\]
Onde:
Q = carga elétrica (C)
i = intensidade da corrente elétrica (A)
t = tempo (s)
Então temos a seguinte expressão:
\[m=K\cdot E\cdot i\cdot t\]
A carga elétrica de 96500 coulomb recebe o nome de Faraday (F).
1F = 96.000 Coulomb
1 Faraday
É a carga elétrica que produz um equivalente-grama de qualquer elemento em uma eletrólise.
Equivale aproximadamente a 96.500 Coulomb
Equivale a carga de um mol (6,02.10²³) de elétrons ou de prótons.
(FUVEST - SP) A eletrólise de cloreto de sódio fundido produz sódio metálico e gás cloro. Nesse processo, cada íon
(UESPI) Em relação à eletrólise, analise as afirmativas seguintes.
1. Em qualquer eletrólise, ocorre uma redução no cátodo e uma oxidação no ânodo.
2. Fundamentalmente, a eletrólise é um processo de oxirredução.
3. A eletrólise de sais só é possível quando os mesmos são dissolvidos em meio aquoso.
4. A eletrólise é uma reação de oxirredução espontânea.
Estão corretas apenas:
(UECE) Uma pilha é formada com eletrodos de alumínio e ouro que apresentam os potenciais de redução, respectivamente, -1,66 volts e 1,50 volts.
Após analisar as características dessa pilha, pode-se afirmar corretamente que
(UFES - ES) A quantidade de metal depositado pela passagem de 0,4 faraday através de uma solução de zinco é igual a:
Zn = 65,4u
(MACKENZIE – SP) Uma corrente de 50 A libera 5,6 g de certo metal de sua solução no fim de 3 minutos e 20 segundos. Calcular o equivalente eletroquímico do metal.
(PUC – MG) Com relação à eletrólise do cloreto de potássio em meio aquoso, feita com eletrodos inertes, é INCORRETO afirmar:
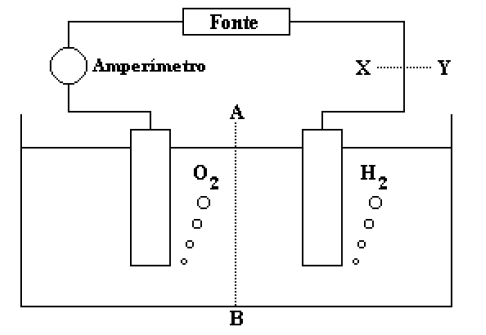
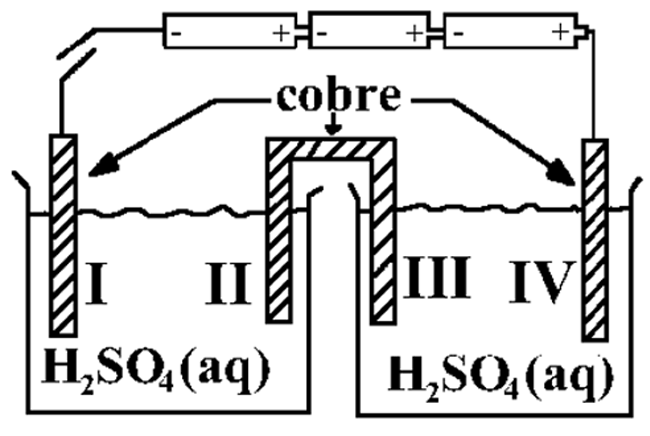
(ITA – SP) A figura abaixo mostra o esquema da aparelhagem utilizada por um aluno para realizar a eletrólise de uma solução aquosa ácida, com eletrodos inertes. Durante a realização da eletrólise, pela secção tracejada (A --- B), houve a seguinte movimentação de partículas eletricamente carregadas através da solução:
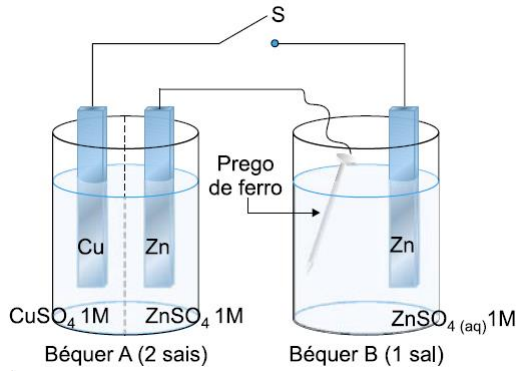
(UFPE - PE) No béquer A, a linha pontilhada representa uma parede porosa que separa as soluções aquosas de \(CuS{{O}_{4}}\,1M\) e de \(ZnS{{O}_{4}}\,1M\).
Considere os potenciais padrão a seguir:
\(\begin{align} &Z{{n}^{2+}}+2{{e}^{-\,}}\to \,Zn\,\,\,\,\,\,\,\,\,\,\,\,\,-0,76v \\ &F{{e}^{2+}}+2{{e}^{-\,}}\to \,Fe\,\,\,\,\,\,\,\,\,\,\,\,\,-0,44v \\ &C{{u}^{2+}}+2{{e}^{-\,}}\to \,Cu\,\,\,\,\,\,\,\,\,\,\,\,\,+0,34v \\ \end{align}\)
Ao fechar a chave “S”, podemos afirmar:
(UFMG - MG) Uma bateria de carro é, basicamente, constituída de placas de chumbo metálico e placas de chumbo recobertas com óxido de chumbo (IV), em uma solução de \({{H}_{2}}S{{O}_{4}}\). Esta equação representa o funcionamento de uma bateria:
Considerando-se essas informações, é INCORRETO afirmar que:
(PUC – PR) Três erres
A produção industrial e a própria sobrevivência humana na Terra estão baseados no desenvolvimento da forma academicamente conhecida como os três erres: Redução, Reaproveitamento e Reciclagem.
Redução é a introdução de novas tecnologias na exploração, no transporte e no armazenamento das matérias primas para reduzir ou, se possível, eliminar o desperdício dos recursos retirados do planeta. Reaproveitamento é a reintrodução, no processo produtivo, de produtos não mais aproveitáveis para o consumo, visando a sua recuperação e recolocação no mercado, evitando assim o seu encaminhamento para o lixo.
Reciclagem consiste na reintrodução dos resíduos sólidos, líquidos ou gasosos já usados para que possam ser reelaborados, gerando um novo produto.
(Banas Ambiental, dezembro de 1999, p.32.)
A produção de alumínio consome uma quantidade enorme de energia elétrica - para produzir 1 kg de alumínio, consome-se 15 vezes mais energia do que para 1 kg de aço.
A solução está na reciclagem do alumínio. O alumínio é refundido e reaproveitado, com uma economia de cerca de 90% de energia.
Dentre as proposições abaixo, assinale a FALSA:
(ACAFE) Metalurgia é como pode ser denominado o processo que produza um metal a partir de seu minério. Na metalurgia do alumínio (processo Hall-Héroult) o alumínio pode ser produzido através da eletrólise ígnea da bauxita (que contém óxido de alumínio) com eletrodos de grafite.
Reações:
\(\begin{align} &2A{{l}_{2}}{{O}_{3}}(s)\,\to \,4A{{l}^{3+}}(l)+6{{O}^{2-}}(l) \\ &4A{{l}^{3+}}(l)+12{{e}^{-}}\to 4Al(l) \\ & 6{{O}^{2-}}(l)\,\to\,12{{e}^{-}}+3{{O}_{2}}(g) \\ &3{{O}_{2}}(g)+3C(s)\,\to \,3C{{O}_{2}}(g) \\ \end{align}\)
Q=i.t; 1F = 96500 C; Al=27g/mol; O=16g/mol; C=12 g/mol.
Considere as informações e os conceitos químicos e analise as afirmações a seguir.
I. A produção do alumínio ocorre no ânodo.
II. O gás oxigênio é produzido no cátodo que reage com o grafite do eletrodo, formando gás carbônica.
III. À medida que a eletrólise acontece, ocorre a diminuição da massa do eletrodo de grafite.
IV. Na eletrólise ígnea do óxido de alumínio após 965 segundos com corrente elétrica (I) igual a 10 A produz 0,9g de alumínio.
Assinale a alternativa correta.
(FUVEST - SP) Com a finalidade de niquelar uma peça de latão, foi montado um circuito, utilizando-se fonte de corrente contínua, como representado na figura.
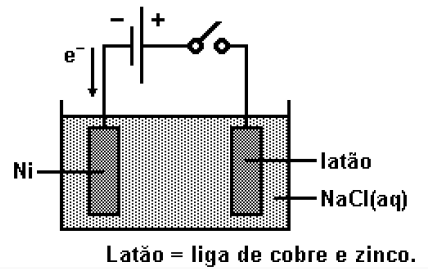
No entanto, devido a erros experimentais, ao fechar o circuito, não ocorreu a niquelação da peça. Para que essa ocorresse, foram sugeridas as alterações:
I. Inverter a polaridade da fonte de corrente contínua.
II. Substituir a solução aquosa de NaCl por solução aquosa de \(NiS{{O}_{4}}\).
III. Substituir a fonte de corrente contínua por uma fonte de corrente alternada de alta frequência.
O êxito do experimento requereria apenas:
(EFEI – SP) A partir do experimento abaixo (numa solução aquosa de \(N{{a}_{2}}S{{O}_{4}}\)), foram feitas as seguintes afirmações:
I. A e B são respectivamente \({{O}_{2}}(g)\) e \({{H}_{2}}(g)\).
II. A e B são respectivamente \({{H}_{2}}O(g)\) e \({{H}_{2}}S(g)\).
III. Forma-se 2 vezes mais B do que A.
IV. B é um gás inflamável.
V. O gás A é muito tóxico.
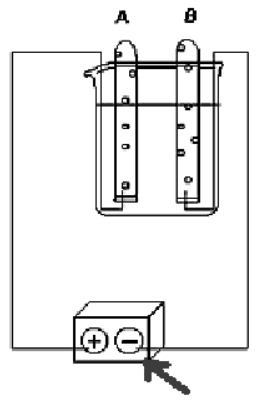
Assinale a alternativa que retrata as afirmações incorretas.
(ITA) Ao se completar o circuito ligando-se o interruptor notar-se-á desprendimento de hidrogênio gasoso apenas no(s) eletrodo(s)
(UEM – PR) Perguntado, em uma prova oral, sobre eletroquímica, um aluno de uma escola de ensino médio respondeu com algumas afirmações, as quais são descritas a seguir. Assinale o que for correto.
Dados:
\(\begin{align} &E_{{{H}^{+}}+{{e}^{-}}}^{0}\,\to \,1/2{{H}_{2}}=0v; \\ &E_{C{{u}^{2+}}2{{e}^{-}}}^{0}\,\to \,Cu=0,376v; \\ \end{align}\)
(UNEMAT – MT) Diferentes marcas de telefones celulares buscam ganhar novos clientes, anunciando que a bateria de seus aparelhos é mais eficiente que a dos concorrentes, por manterem o telefone celular ligado por mais tempo. Quando descarregada, a bateria do celular é conectada a uma rede elétrica para que sua carga seja restabelecida.
Esse processo é um exemplo de:
(UNIOESTE - PR) Ao se lavar roupa com água de lavadeira (água sanitária ou cândida) verifica-se uma reação química que é responsável pelo branqueamento do tecido. Nesta reação, o cloro ataca principalmente as ligações duplas do corante presente no tecido formando um produto incolor. Um dos processos de fabricação do cloro gasoso é por meio da eletrólise de uma solução aquosa concentrada de sal de cozinha, sendo os outros produtos do processo o hidrogênio gasoso e o hidróxido de sódio.
A respeito do exposto, podemos afirmar como correta(s) a(s) seguinte(s) sentença(s).
(UEL - PR) A vantagem principal do magnésio como material de construção é a sua leveza (1,74 g/cm³) quando comparado com o alumínio (2,7 g/cm³) e o aço inoxidável (7,8 g/cm³). É usado em ligas leves e fortes, não só na indústria espacial e aeronáutica, mas também em aparelhos óticos e equipamentos. As ligas de magnésio podem ser extraordinariamente resistentes, sendo empregadas na fabricação de motores e fuselagens de aviões. Anualmente, são produzidas mais de 300.000 toneladas de magnésio, sendo a maior parte pela eletrólise do \(MgC{{l}_{2}}\), presente em grandes quantidades na água do mar.
Fonte: Garritz, A & Chamizo, J. A. Química. Tradução de Giovanni S. Crisi. São Paulo. Prentice Hall, 2002. p. 565.
(Dado: F = 96.500 C)
Com base no texto e nos conhecimentos sobre o tema, é correto afirmar:
(UEM – PR) Qual é a massa aproximada de cádmio que se deposita no cátodo, via eletrólise ígnea, em uma cela eletroquímica que contém \(CdC{{l}_{2}}\) fundido, ao se passar uma corrente de 6 Ampères por 134 minutos?
(Dados: constante de Faraday = 96500 C)
(UEM – PR) Considerando que a semirreação abaixo representa o processo de cromagem, assinale o que for correto.
\[C{{r}_{2}}O_{7}^{2-}+14{{H}^{+}}+12{{e}^{-}}\,\Rightarrow2Cr+7{{H}_{2}}O\]
(UEM – PR) Assinale a(s) alternativa(s) correta(s).
(Dados: Ag = 108; Zn = 65; Faraday = 96500 Coulomb/Mol.)
(UEPG – PR) Dentro de um béquer, dois eletrodos inertes de platina estão imersos em uma solução de cloreto de cobre em água. Esses eletrodos são então ligados a uma bateria externa, o que provoca a eletrólise da solução.
Acerca do sistema assim montado, assinale o que for correto.
(UFSC - SC) A massa atômica de um elemento é 119 u. O número de oxidação desse elemento é + 4. Qual a massa depositada desse elemento, quando se fornece na eletrólise 9.650 Coulomb?
Dado: 1 Faraday = 96.500 C
(FUVEST - SP) Moedas feitas com ligas de cobre se oxidam parcialmente pela ação do ambiente. Para “limpar” estas moedas pode-se utilizar o arranjo esquematizado abaixo. Ao se fechar o circuito, a semi-reação que ocorre na moeda é:
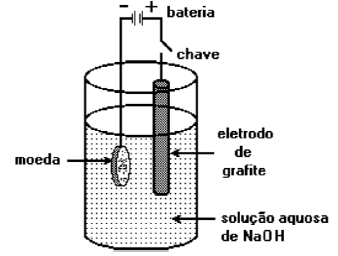
(IME – RJ) Uma solução aquosa de certa substância foi submetida à eletrólise. No cátodo foram recolhidos 11,2 litros de um gás e no ânodo 5,6 litros de outro gás, medidos estes volumes nas CNTP. A substancia dissolvida na solução e a quantidade de eletricidade gasta na eletrólise foram, respectivamente:
(ITA – SP) Uma célula eletrolítica, com eletrodos inertes (platina), contém uma solução aquosa de nitrato de prata acidulada com ácido nítrico. Após o término da eletrólise nota-se que:
1. Num dos eletrodos se formou, a partir da água, exclusivamente \({{O}_{2}}(g)\), num total de 2,0 milimol.
2. No outro eletrodo se depositaram 6,0 milimol de Ag(c) e também se desprendeu \({{H}_{2}}(g)\).
Destas informações dá para concluir que a quantidade de hidrogênio gasoso formada é igual a:
(UERJ) Considere a célula eletrolítica abaixo:
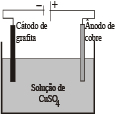
Eletrolisando-se, durante 5 minutos, a solução de \({{H}_{2}}S{{O}_{4}}\) com uma corrente elétrica de 1,9 ampère, verificou-se que a massa de cobre metálico depositada no catodo foi de 0,18 g. Em função dos valores apresentados acima, o rendimento do processo foi igual a:
(UFF – RJ) Uma célula eletrolítica, operando com uma corrente elétrica constante de 0,5 A, nas CNTP, através de uma solução aquosa de \({{H}_{2}}S{{O}_{4}}\), produziu num dos eletrodos, 56,0 mL medidos nas CNTP, de um gás, constituído por uma substância simples. No outro eletrodo, observou-se a evolução de oxigênio.
Dados: volume molar nas CNTP = 22,4 L/mol Faraday = 96.500 C
(UEM – PR) Em uma certa pilha, o eletrólito está contido em um invólucro de zinco que funciona como um dos eletrodos. Que massa de Zn (em gramas) é oxidada a \(Z{{n}^{2+}}\) durante a descarga dessa pilha, por um período de 107h13min20s, envolvendo uma corrente de 0,5 ampère? (Considere Zn = 65)
(UFRJ - RJ) As regiões mais favoráveis para a obtenção de cloreto de sódio a partir da água do mar são as que apresentam grande intensidade de insolação e ventos permanentes. Por esse motivo, a Região dos Lagos do Estado do Rio de Janeiro é uma grande produtora de sal de cozinha.
Determine, em quilogramas, a massa de gás cloro produzida a partir de 11,7 kg de coreto de sódio.
Você chegou ao fim dessa aula com sucesso!
Selecione o botão avançar para seguir para a próxima aula.