Mistura formada por mais de uma fase em que as partículas constituintes são visíveis sem necessidade de microscópio (maiores que 1000 nm). Ex: água e areia.
Mistura em que as partículas presentes têm dimensões entre 1 e 1000 nm, somente visíveis ao microscópio. Ex: água e gelatina.
É uma mistura homogênea, constituída de um solvente (constituinte de maior proporção) e soluto (constituinte de menor proporção), com partículas menores que 1 nm, ou seja, átomos, moléculas ou íons, não sendo visíveis ao microscópio. As soluções podem ser gasosas (mistura de quaisquer gases), líquidas (dois líquidos miscíveis ou um sólido solubilizado em um meio líquido) e sólida (como uma liga metálica, que é a mistura de 2 ou mais metais).
O estudo das soluções em relação a suas concentrações e propriedades focam-se nas soluções aquosas de forma geral, como veremos a diante.

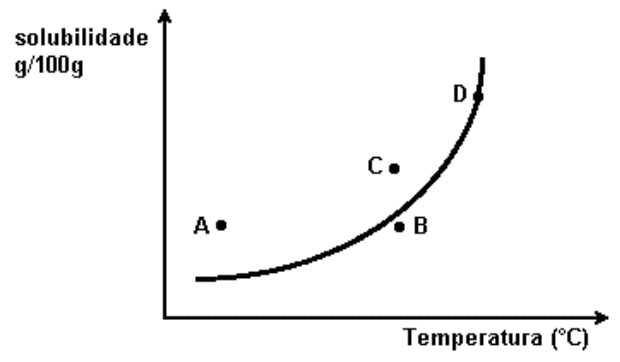
Quando se faz solubilizar um sólido (como por exemplo \(NaCl\)) em água, podemos perceber que com pequenas quantidades do sólido, este se solubiliza por completo. Porém, acima de determinada quantidade, parte se solubiliza e parte se mantém sólida, se depositando como corpo de fundo, e assim a solução atingiu a saturação. A esse limite de saturação chamamos coeficiente de solubilidade. Este determina a quantidade máxima de uma substância que se dissolve numa determinada quantidade de solvente, a uma dada temperatura e pressão.
De forma geral, para sólidos, com o aumento da temperatura, aumenta-se o coeficiente de solubilidade (dissolução endotérmica). Uma exceção é o \(C{{e}_{2}}{{(S{{O}_{4}})}_{3}}\), que apresenta dissolução exotérmica. Já no caso dos gases, o aumento da temperatura diminui a solubilidade.
Essas variações no coeficiente de solubilidade com a temperatura são representadas por meio de curvas de solubilidade.
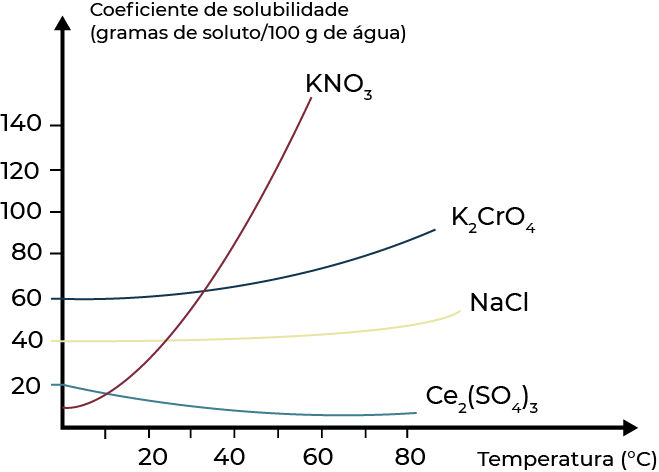
A quantidade de soluto é inferior ao coeficiente de solubilidade em uma dada temperatura e pressão.
A quantidade de soluto solubilizado é exatamente igual o coeficiente de solubilidade. Em casos onde se adiciona mais soluto do que o limite de saturação, a solução final fica saturada e forma-se corpo de fundo.
As soluções supersaturadas são aquelas que apresentam quantidade de soluto dissolvido superior ao coeficiente de solubilidade. Essas soluções são instáveis, ou seja, qualquer perturbação ocasionará a precipitação do soluto excedente ao coeficiente de solubilidade. Para obter tais soluções, a dissolução deve ocorrer em uma temperatura elevada, onde o coeficiente de solubilidade é maior, e então deixa-se a solução resfriar em repouso.

(UNESP – SP) A poluição térmica, provocada pela utilização de água de rio ou mar para refrigeração de usinas termoelétricas ou nucleares, vem do fato da água retornar ao ambiente em temperatura mais elevada que a inicial. Este aumento de temperatura provoca alteração do meio ambiente, podendo ocasionar modificações nos ciclos de vida e de reprodução e, até mesmo, a morte de peixes e plantas. O parâmetro físico-químico alterado pela poluição térmica, responsável pelo dano ao meio ambiente, é:
(MACKENZIE – SP) Um exemplo típico de solução supersaturada é:
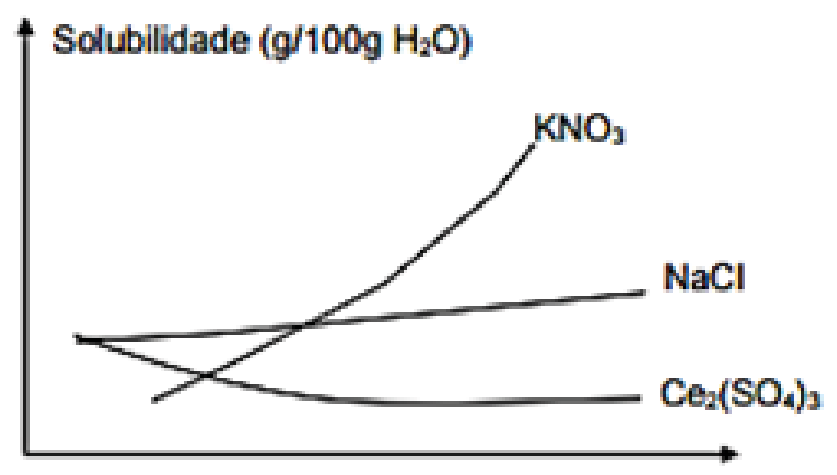
(UFSCAR) As solubilidades dos sais \(KN{{O}_{3}}\) e \(C{{e}_{2}}{{(S{{O}_{4}})}_{3}}\) em água, medidas em duas temperaturas diferentes, são fornecidas na tabela a seguir.
Com base nestes dados, pode-se afirmar que:
(UFRRJ – RJ) Ao analisar o gráfico acima, percebe-se que
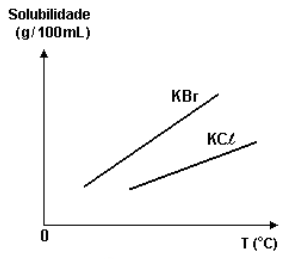
(UFRAVRAS) A curva de solubilidade de um sal hipotético é:
Se a 20 °C misturarmos 20 g desse sal com 100 g de água, quando for atingido o equilíbrio, podemos afirmar que:
(UNIFESP – SP) Uma solução contendo 14 g de cloreto de sódio dissolvidos em 200 mL de água foi deixada em um frasco aberto, a 30 °C. Após algum tempo, começou a cristalizar o soluto. Qual volume mínimo e aproximado, em mL, de água deve ter evaporado quando se iniciou a cristalização? Dados: solubilidade, a 30°C, do cloreto de sódio = 35 g/100 g de água; densidade da água a 30 °C = 1,0 g/mL.
(UCPEL) O processo de recristalização, usado na purificação de sólidos, consiste no seguinte:
1º. Dissolve-se o sólido em água quente, até a saturação.
2º. Resfria-se a solução até que o sólido se cristalize. Os gráficos a seguir mostram a variação, com a temperatura, da solubilidade de alguns compostos em água.
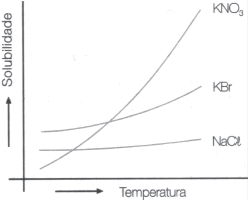
O método de purificação descrito acima é mais eficiente e menos eficiente, respectivamente, para:
(FATEC) As solubilidades em água, a 20 °C, de algumas substâncias e suas respectivas massas molares, são apresentadas na tabela a seguir:
Considerando-se - volumes iguais de soluções saturadas a 20 °C dessas substâncias e - os sais totalmente dissociados. a substância que apresentará maior número de partículas em solução é a de
(FUVEST – SP) NaCl e KCl são sólidos brancos cujas solubilidades em água, a diferentes temperaturas, são dados pelo gráfico a seguir. Para distinguir os sais, os três procedimentos foram sugeridos:
I) Colocar num recipiente 2,5 g de um dos sais e 10,0 mL de água e, em outro recipiente, 2,5 g do outro sal e 10,0 mL de água. Agitar e manter a temperatura de 10 °C.
II) Colocar num recipiente 3,6 g de um dos sais e 10,0 mL de água e, em outro recipiente 3,6 g do outro sal e 10,0 mL de água. Agitar e manter a temperatura de 28°C.
III) Colocar num recipiente 3,8 g de um dos sais e 10,0 mL de água e, em outro recipiente, 3,8 g do outro sal e 10,0 mL de água. Agitar e manter a temperatura de 45 °C.
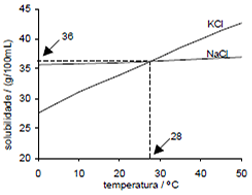
Pode-se distinguir esses dois sais somente por meio
(UEL – PR) A solubilidade das substâncias é, em geral, expressa indicando a massa de soluto necessária para saturar 100 g de solvente. Por exemplo, a solubilidade do sal de cozinha \((NaCℓ)\) é de 36,0 g por 100 g de água, e a do açúcar (sacarose) é de 203,9 g por 100 g de água, ambos a 20 °C. Massas molares (g): \(NaCℓ\) = 58,5; sacarose = 342 Com relação ao texto acima, é correto afirmar:
(FUVEST - SP) Quando o composto \(LiOH\) é dissolvido em água, forma-se uma solução aquosa que contém os íons \(Li\,{{(aq)}^{+}}\) e \(OH (aq)\). Em um experimento, certo volume de solução aquosa de LiOH, à temperatura ambiente, foi adicionado a um béquer de massa 30,0 g, resultando na massa total de 50,0 g. Evaporando a solução até a secura, a massa final (béquer + resíduo) resultou igual a 31,0 g. Nessa temperatura, a solubilidade do \(LiOH\) em água é cerca de 11 g por 100 g de solução. Assim sendo, pode-se afirmar que, na solução da experiência descrita, a porcentagem, em massa, de \(LiOH\) era de
(UNIP) Evapora-se completamente a água de 40 g de solução de nitrato de prata, saturada, sem corpo de fundo, e obtêm-se 15 g de resíduo sólido. O coeficiente de solubilidade do nitrato de prata para 100 g de água na temperatura da solução inicial é:
(UFV – MG) Assinale a alternativa correta. A solubilidade de uma substância é:
(UEM – PR) Um determinado sal X apresenta solubilidade de 12,5 gramas por 100 mL de água a 20ºC. Imagine que quatro tubos contêm 20 mL de água cada e que as quantidades a seguir do sal X foram adicionadas a esses tubos:
- Tubo 1: 1,0 grama;
- Tubo 2: 3,0 gramas;
- Tubo 3: 5,0 gramas;
- Tubo 4: 7,0 gramas.
Após agitação, mantendo-se a temperatura a 20ºC, coexistirão solução saturada e fase sólida no(s) tubo(s)
(UNB – DF) Um balão contendo gás oxigênio (\({{O}_{2}}\)), mantido à pressão constante, tem volume igual a 10 L, a 27 °C. Se o volume for dobrado, poderemos afirmar que:
(UFPR – PR) A solubilidade do cloreto de sódio é de 36,0 g de cloreto de sódio por 100 g de água, a 20°C. Uma solução A, de cloreto de sódio, a 20°C, foi preparada adicionando-se certa massa M de sal a 150 g de água e agitando-se até que todo o sólido fosse dissolvido. À solução A são adicionados 5,0 g de cloreto de sódio sólido. Com o auxílio de um bastão de vidro, agita-se bastante todo o seu conteúdo. Deixando-se repousar, observa-se uma fase líquida B em equilíbrio com um resíduo sólido de cloreto de sódio. O resíduo sólido de cloreto de sódio é separado da fase líquida, constituída da solução B. O sólido é pesado, encontrando-se a massa de 1,0 g, conforme mostra a segunda figura acima. É correto afirmar que:
(UFBA – BA) A tabela a seguir fornece os valores de solubilidade do cloreto de sódio e do hidróxido de sódio, em água, a diferentes temperaturas.
As informações anteriores e os conhecimentos sobre soluções permitem concluir:
(UEM – PR) Dissolvem-se 50 g de sacarose (\({{C}_{12}}{{H}_{22}}{{O}_{11}}\)) em 5000 g (volume de 5,001 L) de água. Sabendo-se que o volume final da solução é 5,002 L, assinale a(s) alternativa(s) que descreve(m) corretamente a solução formada.
(UNIFOR – CE) Dentre os seguintes materiais:
Podem ser classificados como dispersões coloidais:
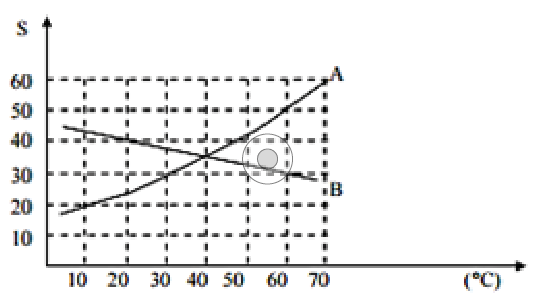
(UEM – PAS) Dado o quadro referente à curva de solubilidade de um sal qualquer AB, cuja massa molar é 100 g/mol, em função da temperatura, e considerando-se que a equação que representa esses dados é da forma y ax b = + , assinale o que for correto.
(UEM – PR) Dado o gráfico da solubilidade x temperatura, podemos afirmar que a solubilidade do:
(UEM - PR) Assinale a soma da(s) correta(s), baseando-se no gráfico abaixo:
(UFRS - RS) Quais são as soluções aquosas contendo uma única substância dissolvida que podem apresentar corpo de fundo dessa substância?
(UNIMONTES – MG) Prepararam-se duas soluções, I e II, através da adição de 5,0 g de cloreto de sódio, NaCl, e 5,0 g de sacarose, \({{C}_{12}}{{H}_{22}}{{O}_{11}}\), respectivamente, a 10 g de água e a 20°C, em cada recipiente.
Considerando que as solubilidades (g do soluto/ 100 g de \({{H}_{2}}O\)) do NaCl e da \({{C}_{12}}{{H}_{22}}{{O}_{11}}\) são 36 e 203,9, respectivamente, em relação às soluções I e II, pode-se afirmar que
(FGV – SP) Na figura, são apresentadas as curvas de solubilidade de um determinado composto em cinco diferentes solventes.
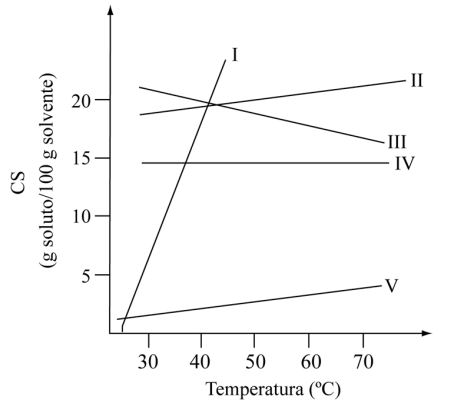
Na purificação desse composto por recristalização, o solvente mais indicado para se obter o maior rendimento no processo é o
(UFRN – RN) A água, o solvente mais abundante na Terra, é essencial à vida no planeta. Mais de 60% do corpo humano é formado por esse líquido. Um dos modos possíveis de reposição da água perdida pelo organismo é a ingestão de sucos e refrescos, tais como a limonada, composta de água, açúcar (glicose), limão e, opcionalmente, gelo.
Um estudante observou que uma limonada fica mais doce quando o açúcar é dissolvido na água antes de se adicionar o gelo. Isso acontece porque, com a diminuição da
(UEM – PR) Os peixes conseguem o oxigênio de que necessitam para respirar, retirando-o:
(UNICAMP – SP) Nas salinas, o cloreto de sódio é obtido pela evaporação da água do mar a 30°C, aproximadamente.
Atenção: nem todos os dados fornecidos a seguir serão utilizados para resolver os itens anteriores.
(FRB – BA) Um balão meteorológico com 50 L de gás hélio, a 20 ºC e ao nível do mar, é lançado na atmosfera. Ao atingir a estratosfera, a pressão desse gás torna-se 0,4 atm e a temperatura, –50 ºC. Determine, em L, a capacidade que o balão deve ter antes do lançamento.
(COVEST – PE) A solubilidade do oxalato de cálcio a 20 °C é de 33,0 g por 100 g de água. Qual a massa, em gramas, de CaC2O4 depositada no fundo do recipiente quando 100 g de \(CaC{{\,}_{2}}{{O}_{4}}(s)\) são adicionados em 200 g de água a 20 °C?
Você chegou ao fim dessa aula com sucesso!
Selecione o botão avançar para seguir para a próxima aula.