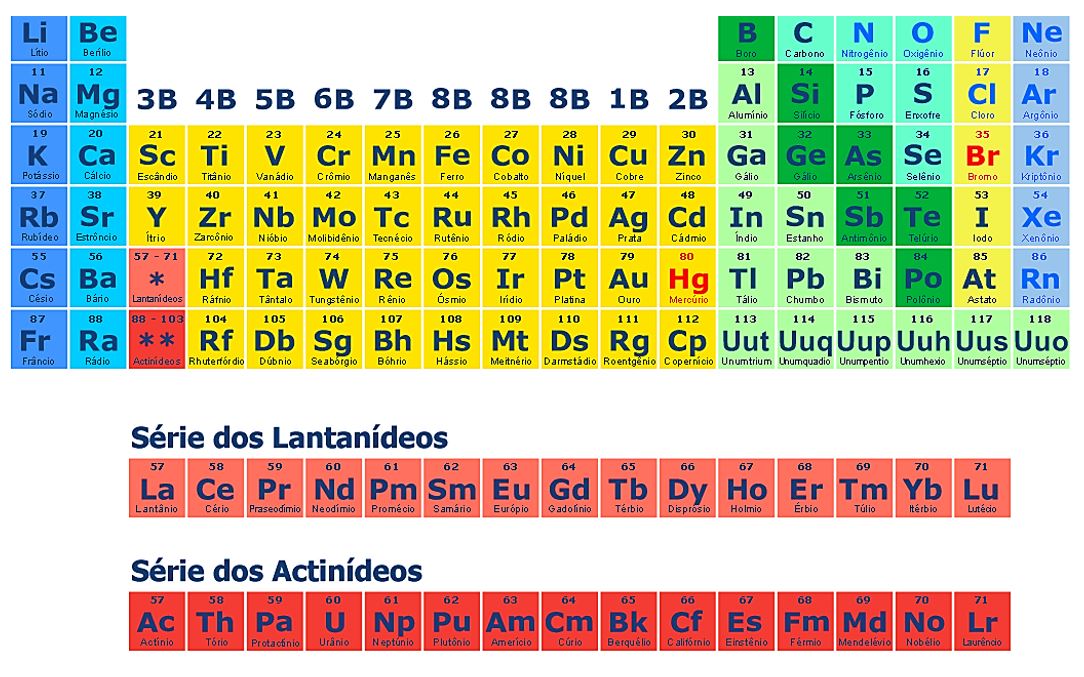
No século XIX, Mendeleev elaborou cartões para cada um dos já conhecidos elementos químicos e percebeu que poderia organizá-los segundo determinadas propriedades, em intervalos regulares. Os elementos com propriedades semelhantes foram organizados numa mesma coluna, e nas linhas, segundo suas massas atômicas. Já Moseley, no início do século XX, percebeu um aprimoramento na organização da tabela organizando-a segundo seu número atômico.

Nos períodos, ou linhas, os elementos são organizados segundo sua ordem crescente de número atômico. De modo a aprimorar a forma da tabela, os elementos de números atômicos de 57 a 71 (lantanídeos) e de 89 a 103 (actinídeos) aparecem em períodos separados, abaixo da tabela. Assim, a tabela fica constituída por 18 colunas (chamados de grupos ou famílias), com elementos de propriedades semelhantes em cada uma delas. Assim temos:
Grupo 1 ou 1A: metais alcalinos; Grupo 2 ou 2A: metais alcalinos-terrosos; Grupo 16 ou 6A: calcogênios; 17 ou 7A: halogênios; grupo 18 ou 0: gases nobres.
Os períodos 1, 2, e 13 a 17 são chamados de elementos representativos, enquanto os dos grupos 3 a 12 são chamados elementos de transição e transição interna (lantanídeos e actinídeos). Os elementos de transição apresentam como subnível mais energético o subnível d, enquanto nos elementos de transição interna, o subnível f.
Também, pode-se agrupar os elementos em diferentes grupos segundo propriedades generalizadas:
Sólidos (exceto Hg), condutores, maleáveis, dúcteis, com brilho.
Isolantes, quebradiços, sem brilho.
Apesar de já em desuso, há a classificação de semimetais para elementos com propriedades intermediárias entre metais e não-metais (B, Si, Ge, As, Sb, Te, Po)
Família 18, gasosos, isolados na natureza.
Não se enquadra em nenhum grupo.
São características que alguns elementos químicos seguem, indicando sua localização na tabela periódica.
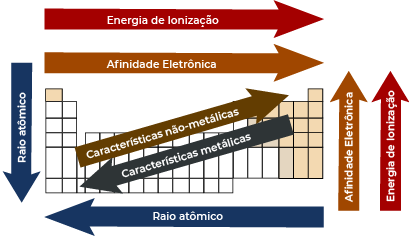
Raio atômico: refere-se ao tamanho do átomo. Aumenta com o aumento do número de camadas, porém para elementos com o mesmo número de camadas, aumenta conforme maior o número de prótons no núcleo. É importante lembrar que na formação de cátion, com perdas de elétrons, haverá aumento da carga nuclear efetiva, e com isso, diminuição do raio. Já na formação do ânion, com ganho de elétrons, haverá expansão do último nível eletrônico, e com isso, aumento do raio.
É a quantidade de energia precisa para se remover um ou mais elétrons de um átomo. Quanto maior o átomo, menor a energia de ionização, portanto essa é contrária ao raio atômico.
É a energia dissipada para que um átomo no estado fundamental receba um elétron. Quanto menor o raio atômico, maior a afinidade eletrônica.
É a força de atração de um átomo sobre os elétrons de uma ligação química. Também cresce de acordo com a diminuição do raio atômico. O elemento mais eletronegativo é o Flúor.
É a razão entre a massa e o volume de um elemento. Nas famílias, aumenta de cima para baixo. Nos períodos, aumenta da extremidade para o centro.
Nas famílias, os pontos de fusão e ebulição aumentam conforme aumenta a densidade, visto que quanto mais denso, mais difícil é a separação dos átomos. Já nas famílias 1A e 2A, aumentam de baixo para cima.
(UESPI) As vitaminas A, C e E possuem propriedades antioxidantes, por isso são importantes no combate aos radicais livres. A vitamina E, por exemplo, ao interagir com o selênio, origina uma potente ação inibidora desses radicais livres. Com relação ao selênio assinale a alternativa correta:
(FUVEST - SP) Em seu livro de contos, O sistema periódico, o escritor italiano Primo Levi descreve características de elementos químicos e as relaciona a fatos de sua vida. Dois trechos desse livro são destacados a seguir.
I - [Este metal] é mole como a cera...; reage com a água onde flutua (um metal que flutua!), dançando freneticamente e produzindo hidrogênio.
II - [Este outro] é um elemento singular: é o único capaz de ligar-se a si mesmo em longas cadeias estáveis, sem grande desperdício de energia, e para a vida sobre a Terra (a única que conhecemos até o momento) são necessárias exatamente as longas cadeias. Por isso, ... é o elemento-chave da substância viva.
O metal e o elemento referidos nos trechos (I) e (II) são, respectivamente:
(PUC – SP) Resolva a questão com base na análise das afirmativas abaixo.
I - A tabela periódica moderna atual está disposta em ordem crescente de massa atômica.
II - Todos os elementos que possuem 1 elétron e 2 elétrons na camada de valência são, respectivamente, metais alcalinos e metais alcalino terrosos, desde que o número quântico principal desta camada (n ≠ 1).
III - Em um mesmo período, os elementos apresentam o mesmo número de níveis (camadas).
IV - Em um mesmo grupo (família), os elementos apresentam o mesmo número de níveis (camadas).
Conclui-se que, com relação à tabela periódica atual dos elementos químicos, estão corretas:
(UEPG - PR) Consulte a tabela periódica e assinale a alternativa cujos elementos químicos, na sequência em que se encontram, pertencem, respectivamente, aos seguintes grupos: calcogênio, metal alcalino terroso, semimetal, metal de transição, gás nobre, halogênio, metal alcalino, não-metal.
(UFPR - PR) A respeito da classificação dos elementos químicos na tabela periódica, é correto afirmar que:
(UNESP) Os elementos I, II e III têm as seguintes configurações eletrônicas em suas camadas de valência:
I – 3s² 3p³;
II – 4s² 4p⁵;
III – 3s².
Com base nessas informações, assinale a afirmação errada.
(UFMG – MG) Em um mesmo período da tabela periódica, o aumento do número atômico é acompanhado pela diminuição do raio atômico. Simultaneamente, há o aumento de todas as seguintes grandezas, exceto:
(UFPE – PE) Considere os átomos X, Y e Z. O átomo X é um metal alcalino, Y representa um elemento do grupo VA (ou 15) da tabela periódica, e Z é um halogênio. Considere que todos os três átomos pertençam ao mesmo período (2° ou 3°). A partir dessas informações, julgue as afirmativas a seguir.
( ) O átomo X possui maior afinidade eletrônica que o átomo Z.
( ) Dos três átomos, o átomo Z possui a maior energia de ionização.
( ) Os átomos X e Z formarão sólidos cristalinos iônicos.
( ) O íon possui raio maior que o íon \({{Y}^{3-}}\).
Assinale a alternativa que representa os itens julgados corretamente em ordem:
(UFMG – MG) Com relação a átomos de oxigênio, todas as afirmativas estão corretas, exceto:
Dado: Z (O) = 8
(FMU – SP) Os valores: 17,4 eV, 13,0 eV e 10,4 eV são as primeiras energias de ionização, não respectivamente, dos elementos Cℓ, F e S. Podemos afirmar que:
(UEPG - PR) Sobre as propriedades periódicas dos elementos químicos, assinale o que for correto.
(UFC – CE) Um átomo X tem um próton a mais que um átomo Y. Com base nesta informação, assinale a alternativa correta.
(IFCE - CE) Com base na tabela periódica, é incorreto afirmar-se que
(PUC – RJ) O flúor é um elemento de número atômico 9 e possui apenas um isótopo natural, o ¹⁹F. Sobre esse elemento e seus compostos, é correto afirmar que:
(UDESC) A tabela periódica dos elementos químicos é, sem dúvida, uma ferramenta bastante útil para prever certas características e propriedades dos elementos químicos. Um exemplo disto é a previsão do comportamento dos átomos e dos compostos químicos por eles formados, ou ainda o porquê de certos átomos serem extremamente reativos, enquanto outros são praticamente inertes.
Com base na tabela periódica dos elementos, assinale a alternativa correta.
(UEPG - PR) O raio atômico de um átomo isolado é calculado a partir da aplicação de técnicas de difração por raios X, sendo um dado muito importante, pois o comportamento dos elementos químicos e muitas das suas propriedades podem ser explicadas a partir dessa informação. Considerando a tabela abaixo e a influência do raio atômico sobre a variação de outras propriedades periódicas, assinale o que for correto.
(UERJ – RJ) Um dos elementos químicos que tem se mostrado muito eficiente no combate ao câncer de próstata é o selênio (Se). Com base na Tabela de Classificação Periódica dos Elementos, os símbolos de elementos com propriedades químicas semelhantes ao selênio são:
(ITA – SP) Assinale a afirmativa falsa relativa à lei periódica dos elementos: As propriedades dos elementos são funções periódicas dos seus pesos atômicos.
(ITA – SP) Dadas as configurações eletrônicas dos seguintes átomos no seu estado fundamental:
I. 1s² 2s² 2p⁶ 3s² 3p⁶
II. 1s² 2s² 2p⁶ 3s²
III. 1s² 2s² 2p⁶ 3s² 3p⁶ 4s¹
IV. 1s² 2s² 2p⁶ 3s² 3p⁵
é errado afirmar que:
(UEMT – MT) As energias de ionização de um metal M são:
1ª Ei = 138.
2ª Ei = 434.
3ª Ei = 656.
4ª Ei = 2767.
Com base nesses dados, espera-se que um átomo desse metal, ao perder elétrons, adquira configuração mais estável quando perde:
(ITA – SP) Qual das opções abaixo apresenta a comparação errada relativa aos raios de átomos e de íons?
(UFMG - MG) Com relação às propriedades periódicas, é correto afirmar que, num mesmo período, os não metais, quando comparados aos metais:
(UEPG - PR) Com relação às propriedades periódicas dos elementos, assinale o que for correto.
(UEM - PR) Assinale o que for correto.
(CESGRANRIO – RJ) Dado os elementos de números atômicos 3, 9, 11, 12, 20, 37, 38, 47, 55, 56 e 75, a opção que só contém metais alcalinos é:
(UEL - PR) A destilação fracionada pode ser utilizada na separação dos:
(IFCE - CE) A tabela periódica é um quadro onde se encontram os elementos atualmente conhecidos. Neste quadro, encontramos vários tipos de elementos classificados de acordo com a sua distribuição eletrônica. Os elementos \({}_{16}S,\,\,{}_{23}V,{}_{25}Mn,{}_{30}Zn\,\,e\,{}_{33}As\) pertencem ao quarto período da tabela periódica. Dentre eles, apresenta(‘m) elétrons desemparelhados, em sua configuração eletrônica, e pode(m) ser classificado(s) como transição:
(ITA – SP) No esquema a seguir, encontramos duas distribuições eletrônicas de um mesmo átomo neutro:
A 1s² 2s².
B 1s² 2s² 2p¹
A seu respeito é correto afirmar:
(PUC – SP) O diagrama de Pauling foi utilizado para a obtenção das estruturas eletrônicas dos elementos com números atômicos 53 e 87. Pede-se:
(UNESP) Em 1962, foi divulgada a preparação do tetrafluoreto de xenônio, pela combinação direta de xenônio com flúor, ambos gasosos, sob altas pressões. Explique por que a preparação do referido composto representou uma mudança no conceito de reatividade dos elementos químicos do grupo do xenônio na tabela periódica.
Você chegou ao fim dessa aula com sucesso!
Selecione o botão avançar para seguir para a próxima aula.