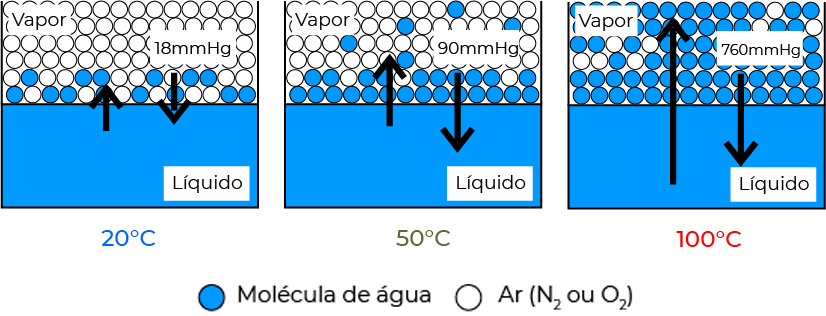
Considere um cilindro vedado por um embolo, apoiado em um liquido contido em seu interior. Elevando o embolo, cria-se um espaço vazio e assim o líquido ali presente iniciará o processo de evaporação. Após um determinado tempo o sistema atinge um equilíbrio em que a velocidade de evaporação das moléculas é a mesma velocidade de condensação do líquido. Nesse equilíbrio, a pressão que o vapor exerce no sistema é a chamada pressão de vapor.
Quando um líquido entra em ebulição, temos então que sua pressão de vapor se igualou a pressão atmosférica. Sendo assim, em situações de pressões diferenciadas, a temperatura de ebulição de um líquido se alterará. Por exemplo, no pico do Everest, a água ferve a 70ºC, enquanto ao nível do mar, a 100ºC.
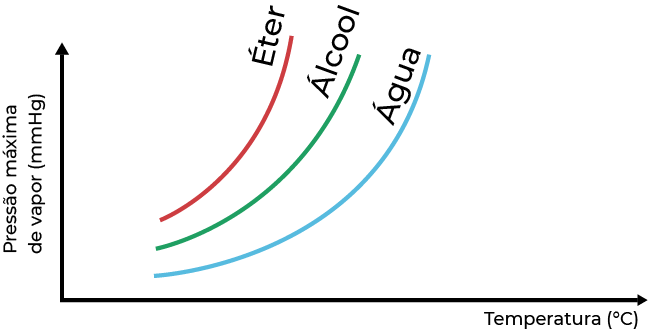
Quanto mais volátil o líquido, maior a pressão de vapor desse, ou seja, mais rapidamente (ou em menor temperatura) entrará em ebulição.
Com o aumento da temperatura, mais rapidamente o líquido entrará em ebulição, e consequentemente maior será a pressão de vapor.
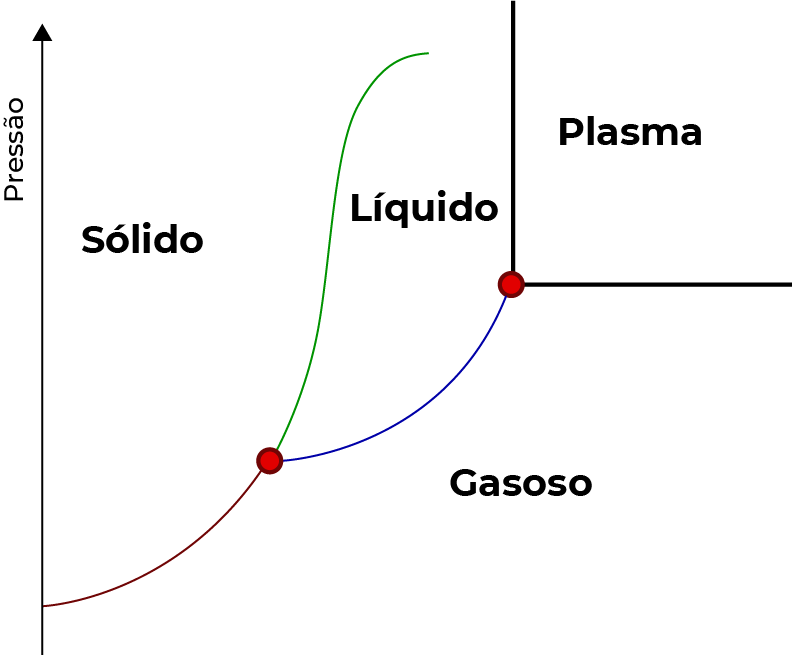
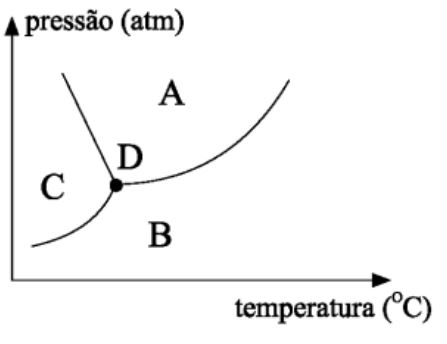
O diagrama de fases é um gráfico que esboça as curvas de temperatura de solidificação e ebulição da água em razão da pressão de vapor. Em situações extremas de temperatura e baixas pressões, ainda temos nesse mesmo gráfico a curva de sublimação. Para a água, o ponto de coincidência entre essas 3 curvas se dá em pressão de 4,579 mmHg e temperatura de 0,01ºC, ao qual denomina-se ponto triplo. Desse diagramas podemos deferir algumas situações:
Em soluções contendo um soluto não volátil, podem ocorrer desvios das propriedades físicas em relação a água pura. Aos efeitos ocasiona os por tais solutos, chamamos propriedades coligativas. Estes não dependem da natureza do soluto, mas apenas do número de partículas em solução. Assim, em soluções iônicas, onde temos formação de íons, o número de partículas em solução, em comparação ao número de partículas de um soluto não iônico, será muito superior. Por consequência, maior intensidade das propriedades coligativas.
É a diminuição da pressão máxima de vapor devido a dissolução de um soluto não-volátil. Ocorre devido a “dificuldade” das moléculas de água escaparem do líquido devido a presença das moléculas de soluto.
É a elevação da temperatura de ebulição de um líquido devido a presença de um soluto não volátil. É uma consequência direta da diminuição da pressão de vapor, já que dessa forma, faz-se maior a temperatura necessária para que um líquido entre em ebulição.
É a diminuição da temperatura de congelamento de um líquido devido a presença de um soluto não volátil. Também é uma consequência direta da diminuição da pressão de vapor.
Considere um sistema formado por duas regiões separadas por uma membrana semipermeável (permeável a água, mas não ao soluto). De um lado da membrana, temos água pura e do outro, temos uma solução contendo um soluto não volátil. A água pura tende a atravessar a membrana, sempre na direção do meio mais diluído (ou da água pura) para o meio mais concentrado. Suponhamos agora que se aplique uma pressão sobre a região contendo a solução, de forma que cesse a osmose. A essa pressão, chamamos pressão osmótica. Esta pode ser obtida por , onde π é a pressão osmótica, V é volume, R é a constante universal dos gases (\(0,082\,atm.L.mol\,.\,{{L}^{-1}}.{{K}^{-1}}\)) , n é o número de mols de soluto e T é a temperatura em K.
(PUC – MG) O gráfico abaixo apresenta a variação das pressões de vapor do sulfeto de carbono, metanol, etanol e água em função da temperatura.
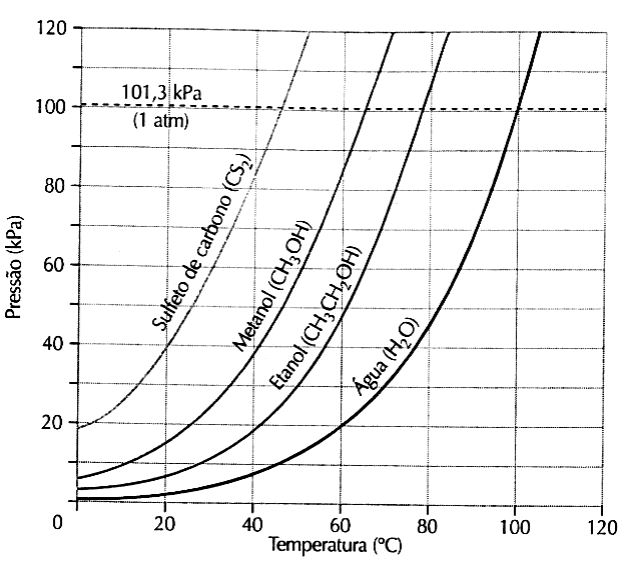
De acordo com o gráfico, assinale a afirmativa INCORRETA.
(FUVEST – SP) Em um mesmo local, a pressão de vapor de todas as substâncias puras líquidas:
(PUC – MG) Sejam dadas as seguintes soluções aquosas:
X - 0,25 mol/L de glicose \(({{C}_{6}}{{H}_{12}}{{O}_{6}})\)
Y - 0,25 mol/L de carbonato de sódio \((N{{a}_{2}}C{{O}_{3}})\)
Z - 0,50 mol/L de ácido nítrico \((HN{{O}_{3}})\)
W - 0,50 mol/L de sacarose \({{C}_{12}}{{H}_{22}}{{O}_{11}})\)
Das soluções acima, assinale a opção que representa a maior pressão de vapor:
(UFTM – MG) Na patinação no gelo, o deslizar do patinador é fácil porque a pressão exercida pelo patim derrete aos poucos o gelo, que volta a se solidificar logo após a passagem do patinador.
No gráfico, essas transformações correspondem, respectivamente, ao trecho:
(UFRGS) A água é fundamental para a vida conhecida na Terra, de modo que a busca de planetas habitáveis ou com vida normalmente envolve, entre outros aspectos, a procura pela existência de água.
Considere as afirmações abaixo, a respeito da água na biosfera.
I. A água é decomposta em oxigênio e hidrogênio, através da respiração dos peixes.
II. A água do mar é inadequada ao consumo humano devido à sua alta pressão osmótica.
III. Águas quentes possuem maior quantidade dissolvida de gás carbônico.
Quais estão corretas?
(FUC – MG) Em uma cidade litorânea tem-se um recipiente com água pura e outro com salmoura. Pode-se concluir que:
(ITA – SP) Considere as duas soluções aquosas seguintes, ambas na mesma temperatura.
SOLUÇÃO I - contém 1,0 milimol de glicose e 2,0 milimols de cloreto de cálcio, \(CaC{{l}_{2}}\), por quilograma de água.
SOLUÇÃO II - contém apenas sulfato férrico dissolvido em água.
Supondo soluções ideais e eletrólitos completamente dissociados, as duas soluções terão os mesmos valores para suas propriedades coligativas se a solução II contiver, por quilograma de água, a seguinte quantidade de \(F{{e}_{2}}{{(S{{O}_{4}})}_{3}}\).
(UNIFOR – CE) São exemplos de propriedades coligativas das soluções aquosas, ou seja, propriedades que praticamente independem da natureza do soluto, mas somente da concentração das partículas (moléculas ou íons em solução) a:
(UFC) Durante o processo de produção da “carne de sol” ou “carne seca”, após imersão em salmoura (solução aquosa saturada de cloreto de sódio), a carne permanece em repouso em um lugar coberto e arejado por cerca de três dias. Observa-se que, mesmo sem refrigeração ou adição de qualquer conservante, a decomposição da carne é retardada. Assinale a alternativa que relaciona corretamente o processo responsável pela conservação da “carne de sol”.
(UEL – PR) Na mesma condição de pressão foram preparadas as seguintes soluções. Em um béquer (béquer 1) foram adicionados 1 kg de água e 1 mol de sacarose \(({{C}_{12}}{{H}_{22}}{{O}_{11}})\). A mistura foi agitada dando origem a uma solução 1. Em outro béquer (béquer 2) foram adicionados 1 kg de água e 1 mol de cloreto de sódio \((NaCl)\). A mistura foi agitada dando origem a uma solução 2. Em outro béquer (béquer 3) foram adicionados 1 kg de água e 1 mol de glicose \(({{C}_{6}}{{H}_{12}}{{O}_{6}})\). A mistura foi agitada dando origem a uma solução 3.
Com relação às soluções contidas nos béqueres 1, 2 e 3 é correto afirmar:
(ITA – SP) Considere as seguintes afirmações relativas aos sistemas descritos abaixo, sob pressão de 1 atm:
I. A pressão de vapor de uma solução aquosa de glicose 0,1mol/L é menor do que a pressão de vapor de uma solução de cloreto de sódio 0,1mol/L a 25°C.
II. A pressão de vapor do n-pentano é maior do que a pressão de vapor do n-hexano a 25°C.
III. A pressão de vapor de substâncias puras como: acetona, éter etílico, etanol e água, todas em ebulição, tem o mesmo valor.
IV. Quanto maior for a temperatura, maior será a pressão de vapor de uma substância.
V. Quanto maior for o volume de um líquido, maior será a sua pressão de vapor.
Destas afirmações, estão CORRETAS
(FURG – RS) No gráfico a seguir, estão representadas as curvas correspondentes à variação da pressão de vapor em função da temperatura de três soluções aquosas diluídas de \({{K}_{2}}S{{O}_{4}}\), NaCl e \(N{{a}_{3}}P{{O}_{4}}\), todas com a mesma concentração em mol/L. Sabendo que as propriedades coligativas dependem do número de partículas existentes na solução e considerando a dissociação completa dos sólidos iônicos em água, pode- se afirmar que as curvas I, II e III correspondem, respectivamente, às soluções aquosas de
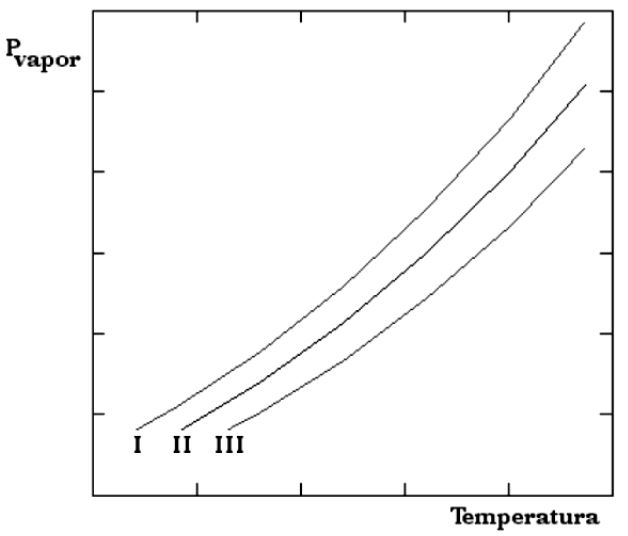
(PUC – MG) Assinale a solução aquosa que irá ferver, em temperatura mais alta:
(PUC – MG) Aquecendo água destilada, numa panela aberta e num local onde a pressão ambiente é 0,92 atm, a temperatura de ebulição da água:
(UEPG – PR) A tabela abaixo mostra a pressão de vapor das substâncias A, B, C e D à mesma temperatura. A respeito dessas substâncias, assinale o que for correto.
(PUC – PR) Propriedades coligativas são aquelas que dependem exclusivamente da quantidade de soluto presente na solução e não da natureza do mesmo. Assim, soluções de mesma molaridade podem apresentar pontos de ebulição diferentes, dependendo do tipo de soluto presente.
Dadas as soluções de igual concentração mol/L, a que apresentará maior temperatura de ebulição será:
(ITA – SP) A tabela abaixo refere-se a quatro substâncias líquidas pouco voláteis e muito solúveis em água, utilizáveis como anticongelantes para água empregada em radiadores de automóveis em regiões muito frias.
Em relação à produção de um mesmo abaixamento da temperatura de início de solidificação, qual das opções abaixo contém a afirmação FALSA?
(UECE – CE) Considerando uma solução de cloreto de potássio de concentração 1,0 mol/L e comparando-se suas propriedades coligativas com água pura, considerando ainda que a pressão externa é de 1 atm, é correto afirmar que
(ITA – SP) Qual das opções a seguir contém a substância no estado sólido que, adicionada à 100 mL de água pura na temperatura de 25oC e em quantidade igual a 0,10 mol, produzirá uma solução aquosa com MAIOR pressão osmótica?
(UFMS – MS) Numa aula de química sobre soluções, o professor fala especificamente sobre soluções aquosas, cujos solutos são não-voláteis. Considerando tais soluções aquosas, em relação à água pura, a uma dada temperatura, é correto afirmar que:
(UEM – PR) Assinale o que for correto.
(UEM – PR) Considere duas soluções A e B. A solução A é constituída de 1,0 L de\(A{{l}_{2}}{{(S{{O}_{4}})}_{3}}_{(aq)}\) 0,15 mol/L e a solução B é constituída de 1,0 L de \(BA{{(S{{O}_{3}})}_{2}}_{(aq)}\) 0,15 mol/L. Sabendo-se que os sais estão 100% ionizados nas soluções e que ambas estão ao nível do mar, assinale o que for correto.
(UFSC) Ao colocar-se uma célula vegetal normal, numa solução salina concentrada, observar-se-á que ela começará a “enrugar” e a “murchar”.
Sobre esse fenômeno, é correto afirmar:
(UFOP – MG) Assinale a(s) alternativa(s) correta(s).
(UEM – PR) Sabendo-se que o sangue humano possui uma pressão osmótica de 7,8 atm a 37ºC, a massa de glicose ($({{C}_{6}}{{H}_{12}}{{O}_{6}})$) usada para preparar um litro de uma solução isotônica a essa temperatura é, aproximadamente,
(Dados: constante dos gases = \(0,082atm\,L mo{{l}^{-1}}{{K}^{-1}}\))
(UFSC) Em relação as proposições abaixo, é correto afirmar que:
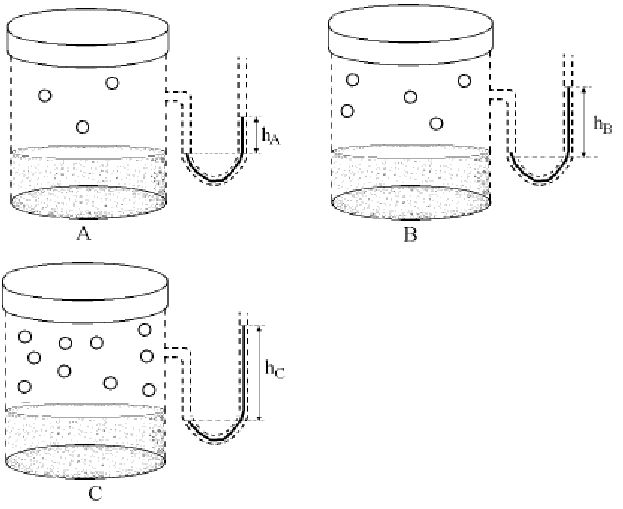
(UEM – PR) Considere as figuras a seguir, a 250C, e assinale a(s) alternativa(s) correta(s).
(UFPE – PE) A Tabela abaixo apresenta a variação da pressão de vapor em função da temperatura para naftaleno (sólido), benzeno (líquido) e água (líquida). Analise as afirmações a seguir:
(UERJ – RJ) O Mar Morto apresenta uma concentração salina de 280 \(g × {{L}^{-1}}\), enquanto nos demais mares e oceanos essa concentração é de 35 \(g × {{L}^{-1}}\)
Considere as três amostras abaixo, admitindo que as soluções salinas apresentadas contenham os mesmos constituintes:
Indique a amostra que apresenta a maior temperatura de ebulição, justificando sua resposta. Em seguida, calcule o volume da amostra B a ser adicionado a 7 L da amostra A para formar uma nova solução salina que apresente a mesma concentração da amostra C.
(ITA – SP) Explique por que água pura exposta à atmosfera e sob pressão de 1,0 atm entra em ebulição em uma temperatura de 100°C, enquanto água pura exposta à pressão atmosférica de 0,7 atm entra em ebulição em uma temperatura de 90°C.
Você chegou ao fim dessa aula com sucesso!
Selecione o botão avançar para seguir para a próxima aula.