É a quantidade de calor de um sistema, numa determinada pressão constante. Com calorímetros, que são os instrumentos usados para se medir o calor envolvido nas reações, não se pode determinar em absoluto a entalpia, mas sim a variação desta durante o processo de reações químicas. A variação de entalpia (ΔH) é a diferença entre a entalpia final (dos produtos) e inicial (dos reagentes), e é dada em J ou cal, ou ainda kJ e kcal (1 cal = 4,18 J).
São aquelas reações, em que há liberação de calor para o meio, ou seja, a entalpia dos produtos é menor que a dos reagentes.

São aquelas reações, em que há absorção de calor do ambiente, ou seja, a entalpia dos produtos é superior à dos reagentes.
Pode-se representar as reações com variação de entalpia por meio de diagramas de entalpia, em que representa-se os produtos e reagentes com suas respectivas entalpias, e a variação desta, indicada por uma seta no sentido da ocorrência da reação. Quando a seta aponta para cima, o é positivo, já a seta apontando para baixo indica negativo.
A variação da entalpia das reações pode sofrer influência de fatores característicos dos reagente e produtos, como veremos a seguir.
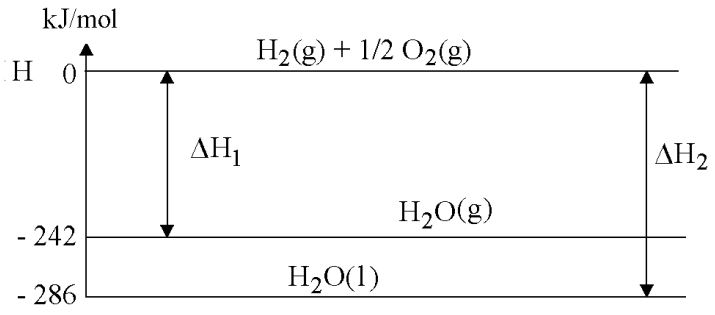
Reações que ocorrem a partir de reagentes iguais, no mesmo estado físico, porém, obtendo produtos em estados físicos diferentes, terão variações de entalpia diferentes. Por exemplo, na reação de formação de um mol de água, temos:
Reações envolvendo substância em diferentes formas alotrópicas apresentam variações de entalpias diferentes, devido a diferença de entalpia dessas substâncias. Para as principais espécies alotrópicas, temos que:
\(\begin{align} &{{H}_{diamante}}>{{H}_{grafite}};{{H}_{Smonocl\acute{i}nico}}>{{H}_{Sr\hat{o}mbico}};\\ &{{H}_{Pbranco}}>{{H}_{Pvermelho}};{{H}_{O3(ox\hat{o}nio)}}H{{O}_{2(oxig\hat{e}nio)}}\\ \end{align}\)
A variação de entalpia é diretamente proporcional a quantidade de reagentes envolvidos. Se conhecemos de uma reação com uma determinada quantidade de mols de substância, será o dobro para a mesma reação com o dobro da quantidade molar, ou o triplo, sucessivamente:
\[A\,+B\,\to\,C\,\,\Delta H=-50KJ\,\,\,\,\,\,\,\,\,\,\,\,2A+2B\,\to \,2C\,\,\, \Delta H = -100kJ\]
Devido a impossibilidade de se determinar exatamente a entalpia de um sistema, adota-se o conceito de estado padrão, ao qual atribui-se o valor de entalpia zero. Para considerar-se uma substância como sendo o estado padrão, segue-se as condições: Temperatura =25ºC; Pressão= 1atm; estado físico mais comum a 25ºC e 1 atm \((Ex.\,\,{{H}_{2}}{{O}_{(l)}},{{O}_{2(g)}},A{{l}_{(s)}})\); forma alotrópica mais estável \(({{C}_{(gr)}},{{O}_{2(g)}},{{S}_{(R)}})\), ser substância simples.
É a entalpia envolvida numa reação química. Pode-se denominar a variação de entalpia ou calor conforme o tipo de reação estabelecida.
Entalpia de formação: é a quantidade de calor absorvido ou liberado numa reação para a formação de 1 mol de um composto, tendo como reagentes substâncias simples no estado padrão. Ex. \(({{H}_{2(g)}}+{\scriptstyle{}^{1}/{}_{2}}{{O}_{2(g)}}\,\to1{{H}_{2}}{{O}_{(l)}}Kj/mol)\).
Como nas reações de formação a entalpia dos reagentes será sempre zero (visto que estão no estado padrão), então a entalpia de formação será a entalpia de 1 mol do próprio composto obtido.
É a variação de entalpia decorrente da reação de combustão de 1 mol de determinada substância a 25ºC e 1 atm. As entalpias de combustão são sempre negativas, visto que reações desse tipo são sempre exotérmicas.
É a energia necessária para romper a ligação de um mol de átomos de um reagente no estado gasoso.
\[C{{l}_{2(g)}}\,\to 2C{{l}_{(g)}}\,\,\,\Delta H=+58kcal\]
A variação de entalpia de uma reação depende apenas dos estados finais e iniciais, e não do caminho da reação. Assim, partindo de diversas reações, devemos arranjá-las de modo que a reação final seja aquela desejada. – Somando as reações, soma-se o. Invertendo as reações, muda-se o sinal do Multiplicando uma reação por um nº qualquer que não zero, multiplica-se também o valor de pelo mesmo nº.
\[\Delta H={{H}_{f}}-{{H}_{i}}\]
(IFCE) O menor dos hidrocarbonetos, o metano (CH4), é um gás incolor e pode causar danos ao sistema nervoso central se for inalado. Pode ser obtido da decomposição do lixo orgânico, assim como sofrer combustão como mostra a reação balanceada:
\[C{{H}_{4(g)}}+2{{O}_{2(g)}}\,\to\,C{{O}_{2(g)}}+2{{H}_{2}}{{O}_{(l)\,}}\,\,\Delta H=-890kj\]
A massa de metano que, em g, precisa entrar em combustão para que sejam produzidos exatamente 54 g de água é igual a
Dados: M(H) = 1 g/mol, M(C) = 12 g/mol e M(O) = 16 g/mol.
(UNESP – SP) Em uma cozinha, estão ocorrendo os seguintes processos:
I. gás queimando em uma das “bocas” do fogão e
II. água fervendo em uma panela que se encontra sobre esta “boca” do fogão.
Com relação a esses processos, pode-se afirmar que:
(UFRGS) Considere a reação de hidrogenação do ciclopenteno, em fase gasosa, formando ciclopentano, e a tabela de entalpias de ligação, mostradas abaixo.
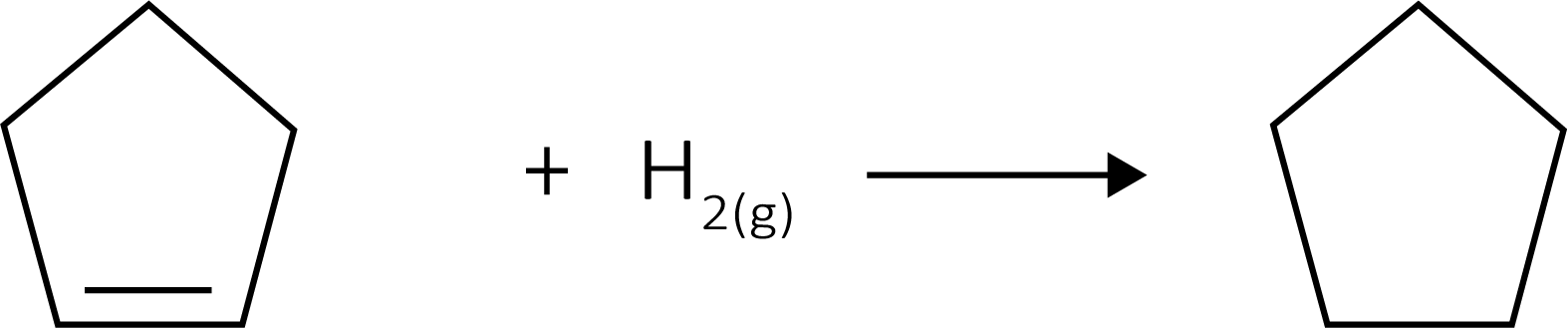
Qual será o valor da entalpia da reação de hidrogenação do ciclopenteno em kj/mol?
(FEPECS – DF) No dia 20 de dezembro de 2002 o jornal “O Globo” publicou uma informação científica sobre a transformação de restos mortais em diamantes.
“Diamantes sintéticos surgiram em meados dos anos 50 quando a GE desenvolveu um processo para criar pedras desse tipo para uso industrial, a partir do grafite. Quem percebeu a possibilidade de cinzas de restos humanos se transformarem em diamante foi Rusty VanderBiesen, hoje presidente da firma. Como o corpo humano é feito de carbono, matéria essencial dos diamantes, ele imaginou que deveria haver uma maneira de produzir pedras preciosas a partir de restos humanos”.
Grafite e diamante são variedades alotrópicas do elemento carbono que se diferenciam entre si pelo arranjo cristalino. Enquanto o grafite apresenta brilho metálico e pode ser quebrado com pouco esforço, o diamante é o material mais duro da natureza. Uma outra evidência da diferença entre eles é a quantidade de calor trocado na combustão, conforme as seguintes equações termoquímicas:
\[\begin{align} &{{H}_{(grafite)}}+{{O}_{2(g)\,}}\to\,C{{O}_{2(g)}}\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\Delta{{H}_{(25{}^\text{o}C,\,1atm)}}+-393,7Kj \\ &{{H}_{(diamente)}}+{{O}_{2(g)\,}}\to\,C{{O}_{2(g)\,}}\,\,\,\,\,\,\,\,\,\,\,\,\,\,\Delta{{H}_{(25{}^\text{o}C,\,1atm)}}+-395,6Kj \\ \end{align}\]
Com essas informações, está correto afirmar que a energia, em kj, necessária para transformar 48g de grafite em diamante é igual a:
(UERJ – RJ) Ao se dissolver uma determinada quantidade de cloreto de amônio em água a 25°C , obteve-se uma solução cuja temperatura foi de 15°C . A transformação descrita caracteriza um processo do tipo:
(UPF) Soluções aquosas de hidróxido de magnésio são utilizadas para aliviar indigestão e azia, ou seja, elas se comportam como um antiácido. A obtenção de hidróxido de magnésio pode ser realizada a partir da reação de magnésio metálico com a água. A equação dessa reação química e o valor da entalpia são assim representados:
\[\begin{align} &Mg(s)+2{{H}_{2}}O(\ell )\,\to \,Mg{{(OH)}_{2(s)}}+{{H}_{2(g)}} \\ & \Delta H = -353Kjmo{{l}^{-1}}\,de\,M{{g}_{(s)}} \\ \end{align}\]
Essa reação é _____ e ao reagir 350 g de Mg(s), nas mesmas condições, a energia _____, em kJ, será de _____.
Dados: Mg = 24,3.
Assinale a alternativas cujas informações preenchem corretamente as lacunas do enunciado.
(UEG) No gráfico a seguir, é apresentada a variação de energia durante uma reação química hipotética.
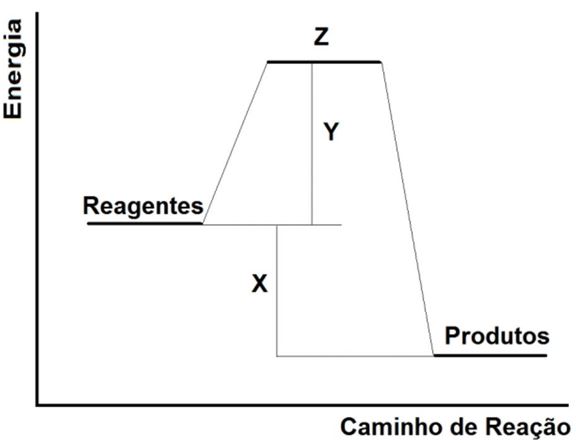
Com base no gráfico, pode-se correlacionar X, Y e Z, respectivamente, como
(IFBA) Para transformar grafite em diamante, é preciso empregar pressão e temperatura muito elevadas, em torno de 105 atm e 2.000 °C. o carbono precisa ser praticamente vaporizado e, por isso, apesar de o processo ser possível, é difícil. Consideremos, então, as entalpias de combustão do grafite e do diamante:
\[\begin{align} &I.\,\,{{H}_{(grafite)}}+{{O}_{2(g)\,}}\to \,C{{O}_{2(g)}}\,\,\,\Delta H = -394Kj\\ &II.\,\,{{H}_{(diamante)}}+{{O}_{2(g)\,}}\to \,C{{O}_{2(g)\,}}\,\,\Delta H = -396Kj \\ \end{align}\]
Quantos kj são necessários para transformar grafite em diamante?
(UEM – PR) Sabendo que a combustão completa de 1 mol de metano libera 802 kj de energia; que a combustão completa de 1 mol de etanol libera 1.350 kj de energia e que o gás oxigênio 20% do volume total do ar, assinale o que for correto.
(ENEM) O carro flex é uma realidade no Brasil. Estes veículos equipados com motor que tem capacidade de funcionar com mais de um tipo de combustível. No entanto, as pessoas que têm esse tipo de veículo, na hora do abastecimento, têm sempre a dúvida: álcool ou gasolina? Para avaliar o consumo desses combustíveis, realizou-se um percurso com um veículo flex, consumindo 40 litros de gasolina e no percurso de volta utilizou-se etanol. Foi considerado o mesmo consumo de energia tanto no percurso de ia quanto no de volta.
O quadro resume alguns dados aproximados sobre esses combustíveis.
O volume de etanol combustível, em litro, consumido no percurso de volta é mais próximo de
(FAMERP) A energia liberada na combustão do etanol hidratado é cerca de 70% da energia liberada na energia de igual volume de gasolina. Considere que o calor específico da água líquida seja 1 \(cal\,{{g}^{-1}}.\,\,{}^\text{o}{{C}^{-1}}\). Em um experimento, a combustão de um volume V de etanol hidratado em um calorímetro permitiu elevar a temperatura de 200 g de água líquida de 25 °C a 60° C. Caso fosse utilizado nesse experimento igual volume de gasolina no lugar do etanol, a temperatura dessa mesma massa de água iria variar de 24 °C até
(UEFS)
Um motociclista fo ide Salvador – BA para Feira de Santana – BA, percorrendo no total 110,0 km. Para percorrer o trajeto, sua motocicleta flex consumiu 5 litros de etanol \(({{C}_{2}}{{H}_{5}}OH\,\,d\,=\,0,8\,g.c{{m}^{-3}})\), tendo um consumo médio de 22,0 km/L. Com base nos dados de entalpia de formação de algumas substâncias, o calor envolvido na combustão completa por litro de etanol foi, em kJ, aproximadamente,
(UEPG – PR) A química, como qualquer outra ciência, tem linguagem e terminologia próprias e a sua interpretação é fundamental para a compreensão dos seus significados. Por exemplo, a fotossíntese, essencial para o processo da vida na Terra, é representada como a seguir.
\[6C{{O}_{2}}\,\,+\,\,6{{H}_{2}}O\,\,+\,\,energia\,solar\,\to\,{{C}_{6}}{{H}_{12}}{{O}_{6}}\,+\,6{{O}_{2}}\]
Sobre essa representação, assinale o que for correto.
(UEM – PR) Assinale o que for correto.
(UFMG – MG) À temperatura de 25ºC, as reações de combustão do etanol e do hexano podem ser representadas por estas equações:
\[\begin{align} &{{C}_{2}}{{H}_{5}}OH(l)+3{{O}_{2}}(g)\,\to \,2C{{O}_{2}}(g)+3{{H}_{2}}O(l) \\ & \Delta H = -1,4\times {{10}^{3}}kJ/mol \\ &{{C}_{6}}{{H}_{14}}(l)+{{O}_{2}}(g)\,\to \,6C{{O}_{2}}(g)+7{{H}_{2}}O(l) \\ & \Delta H = -4,2\times {{10}^{3}}kJ/mol \\ \end{align}\]
Considerando-se essas informações, é CORRETO afirmar que a massa de etanol, \(\,{{C}_{2}}{{H}_{5}}OH\), necessária para gerar a mesma quantidade de calor liberada na queima de 1 mol de hexano, \(\,{{C}_{6}}{{H}_{14}}\), é de, aproximadamente,
(UESPI) O peróxido de hidrogênio que, em solução aquosa, é conhecido comercialmente como água oxigenada, é um líquido claro de fórmula química \(\,{{H}_{2}}{{O}_{2}}\). Recentemente foi utilizado de forma ilegal, juntamente com o hidróxido de sódio, para aumentar o volume de comercialização de leite. No leite a água oxigenada sofre um processo de decomposição dado pela equação:
\(2{{H}_{2}}{{O}_{2}}(l)\,\to\,2{{H}_{2}}O(l)\,+\,{{O}_{2}}_{(g)}\), com um \(\Delta H\) = -196Kj
Em relação a este processo, qual o calor (q) desprendido na decomposição de 5,0g de \(\,{{H}_{2}}{{O}_{2}}(l)\) a pressão constante?
(Dados de massa atômica: H=1; O=16.)
(EsPCEx – Aman) O propano-2-ol (álcool isopropílico), cuja fórmula é \(\,{{C}_{3}}{{H}_{8}}O\), é vendido comercialmente como álcool de massagem ou de limpeza de telas e de monitores. Considerando uma reação de combustão completa com rendimento de 100% e os dados de entalpias padrão de formação (DH°f) das espécies participantes desse processo e da densidade do álcool, a quantidade de energia liberada na combustão completa de 10,0L desse álcool será de
(UFRRJ) Ao se misturar 20 mL de água com 10 mL de ácido sulfúrico concentrado, a temperatura sobe de 25°C para 80 °C logo após a adição do ácido.
Isso ocorre devido à
(UFRRJ) Desde a pré-história, quando aprendeu a manipular o fogo para cozinhar seus alimentos e se aquecer, o homem vem percebendo sua dependência cada vez maior das várias formas de energia. A energia é importante para o uso industrial e doméstico, nos transportes, etc.
Existem reações químicas que ocorrem com liberação ou absorção de energia, sob a forma de calor, denominadas, respectivamente, como exotérmicas e endotérmicas. Observe o gráfico a seguir e assinale a alternativa correta:
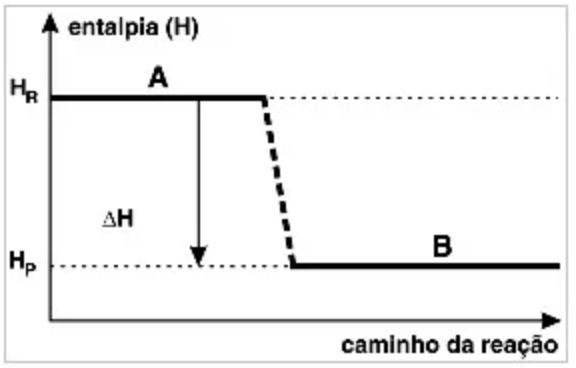
(UEM – PR) Observe o diagrama abaixo, a 250ºC e 1 atm, e assinale a(s) alternativa(s) correta(s).
(UEM – PR) Admitindo-se que a reação
\[{{C}_{8}}{{H}_{18}}+\frac{25}{2}{{O}_{2}}\,\to\,8C{{O}_{2}}+9{{H}_{2}}O+calor\]
se complete no sentido indicado, assinale a alternativa correta.
(UFRGS) Considere as seguintes afirmações sobre termoquímica.
I. A vaporização do etanol é um processo exotérmico.
II. Os produtos de uma reação de combustão têm entalpia inferior aos reagentes.
III. A reação química da cal viva (óxido de cálcio) com água é um processo em que ocorre absorção de calor.
Quais estão corretas?
(UEPG – PR) Considere as equações químicas representativas da combustão do metano, em etapas:
Primeira etapa:
\(\,C{{H}_{4(g)}}\,\to\,{{C}_{(s)}}\,+\,2{{H}_{2(g)}}\,\,{{H}_{1}}\,=+17,9Kcal\)
Segunda etapa:
\(\,2{{H}_{2(g)}}\,+\,{{O}_{2}}\,\to\,2{{H}_{2}}{{O}_{(l)}}\,\,\Delta {{H}_{2}}\,=-136,6Kcal\)
Terceira etapa:
\(\,{{C}_{(s)}}\,+\,{{O}_{2(g)}}\,\to\,C{{O}_{2(g)}}\,\,\Delta \,{{H}_{3}}\,=-94,1Kcal\)
Etapa global:
\(\,C{{H}_{4(g)}}\,+\,2{{O}_{2(g)}}\,\to\,C{{O}_{2(g)}}+2{{H}_{2}}{{O}_{(l)}}\,\,\,\,\,\,\,\,\,\Delta \,{{H}_{c}}\,=?\)
Assinale o que for correto.
(MACKENZIE – SP) A respeito da combustão completa de 1 mol de gás propano, no estado padrão, são feitas as seguintes afirmações:
I. Trata-se de um processo endotérmico.
II. Ocorre com liberação de energia para o meio externo.
III. Há a formação de 3 mols de dióxido de carbono e 4 mols de água.
IV. São consumidos 5 mols de gás oxigênio.
Analisando-se as afirmações acima, estão corretas somente
(MACKENZIE – SP) O etanol, produzido por meio da fermentação do açúcar extraído da cana-de-açúcar, é um combustível renovável extremamente difundido no território nacional, e possui entalpia-padrão de combustão de -1.368 \(KJ.mo{{l}^{-1}}\). Considerando-se os dados fornecidos na tabela abaixo, é correto afirmar que, a entalpia-padrão de formação do etanol é de
(UEM – PR) Observe os dados a seguir
\[\begin{align} &2M{{g}_{(s)}}+{{O}_{2(g)}}\,\to \,2Mg{{O}_{(s)}}\,\,\,\,\,\,\,\,\Delta H {}^\text{o}=-1203,6Kj \\ &Mg{{(OH)}_{(s)}}\,\to \,Mg{{O}_{(s)}}+{{H}_{2}}{{O}_{(l)}}\,\,\Delta H {}^\text{o}=+37,1Kj \\ &2{{H}_{2(g)}}+{{O}_{2(g)}}\,\to \,2{{H}_{2}}{{O}_{(l)\,}}\,\,\,\,\,\,\,\,\,\,\,\,\Delta H {}^\text{o}=-571,7Kj \\ \end{align}\]
Baseando-se no exposto acima, a entalpia padrão do \(Mg{{(OH)}_{2(s)}}\), a 25 ºC e 1 atm, é, aproximadamente,
(UERJ) O trióxido de enxofre é um poluente secundário, formado a partir da oxidação do dióxido de enxofre, poluente primário, em presença do oxigênio atmosférico.
Considere as seguintes entalpias-padrão de formação a 25 ºC e 1 atm:
\[\begin{align} &S{{O}_{2}}=-296,8Kj\,\times mo{{l}^{-1}} \\ &S{{O}_{3}}=-394,6Kj\,\times mo{{l}^{-1}} \\ \end{align}\]
Determine a variação de entalpia da reação de oxidação do dióxido de enxofre e apresente a fórmula estrutural plana do trióxido de enxofre.
(FUVEST – SP) Existem vários tipos de carvão mineral, cujas composições podem variar, conforme exemplifica a tabela a seguir.
* Considere semelhante a composição do material volátil para os quatro tipos de carvão.
** Dentre os outros constituintes, o principal composto é a pirita, \(F{{e}^{2+}}S_{2}^{2-}\).
Dados:
entalpia de formação do
dióxido de carbono gasoso .... – 400 kJ/mol
massa molar do carbono ........ 12 g/mol
(UFOP – MG) O carbeto de tungstênio (WC) é usado em brocas de perfuração de poços de petróleo. A medição experimental do calor de formação do WC é tarefa difícil devido à alta temperatura em que a reação ocorre. Entretanto, o calor de formação do WC pode ser calculado a partir dos calores de combustão das substâncias abaixo:
\[\begin{align} &{{W}_{(s)}}+{3}/{2}\;{{O}_{2(g)\,}}\to\,W{{O}_{3(S)}}\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\Delta H = -840kj/mol \\ &{{C}_{(grafite)}}+{{O}_{2(g)}}\,\to \,C{{O}_{2(g)}}\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\Delta H = -394Kj/mol \\ &W{{C}_{(s)}}+{5}/{2}\;{{O}_{2(g)}}\,\to\,W{{O}_{3(s)}}+C{{O}_{2(g)\,}}\,\,\,\,\,\,\Delta H = -1196kj/mol \\ \end{align}\]
(UEPG – PR) Considere a seguinte equação de decomposição do ácido iodídrico:
\(Hl\,\to\,{1}/{2}\;\,{{H}_{2}}{{l}_{2}}\,\to \,{1}/{2}\;\,{{H}_{2}}+\,{1}/{2}\;\,{{l}_{2}}\) complexo ativado
\(\Delta H=-6Kcal.mo{{l}^{-1}}\)
Para ocorrer a liberação de 336 Kcal, quantos mols de HI devem ser decompostos?
Você chegou ao fim dessa aula com sucesso!
Selecione o botão avançar para seguir para a próxima aula.