Velocidade de reação, efeito da concentração (reações elementares e não elementares), colisões (energia de ativação), efeito da temperatura, efeito do catalisador, efeito da superfície de contato.
Velocidade de reação: é a taxa de consumo dos reagentes ou de formação dos produtos, em relação ao tempo da reação. De modo geral, é dada por:
\[Vm=\frac{\Delta \,quantidade}{\Delta \,tempo}\]
Se considerarmos a reação \({{N}_{2(g)}}+3{{H}_{2(g)}}\to2N{{H}_{3}}_{(g)}\), temos que a velocidade de consumo dos reagentes deve ser calculada em módulo, caso contrário, esta velocidade seria negativa. Assim:
\[\begin{matrix} Vm\,\,consumo\,\,{{N}_{2}}=\frac{\left| \Delta\,concentra\tilde{a}o\,\,{{N}_{2}} \right|}{\Delta \,tempo} \\ \begin{matrix} e \\ Vm\,\,consumo\,\,{{H}_{2}}=\frac{\left| \Delta\,concentra\tilde{a}o\,\,{{H}_{2}} \right|}{\Delta \,tempo} \\ \end{matrix} \\\end{matrix}\]
Já a velocidade de formação do produto é dada por:
\[Vm\,\,consumo\,\,N{{H}_{3}}=\frac{\left|\Delta \,concentra\tilde{a}oN{{H}_{3}} \right|}{\Delta \,tempo}\]
A velocidade média da reação, sem especificação de formação ou consumo, pode ser obtida por:
\[Vm=\frac{Vm\,\,{{N}_{2}}}{1}=\frac{Vm\,\,N{{H}_{2}}}{3}=\frac{Vm\,\,N{{H}_{3}}}{2}\]
Condições de ocorrência da reação: Para que uma reação química se processe, algumas condições devem ser consideradas.
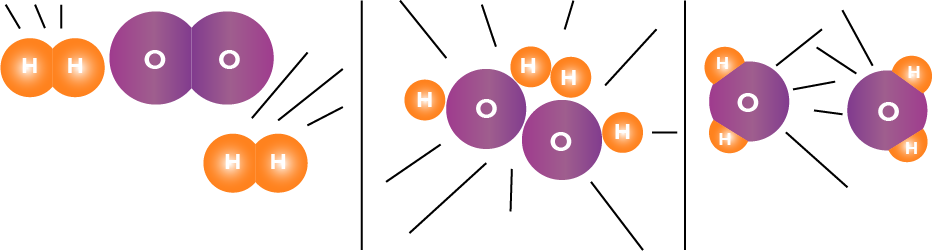
Afinidade química: é a tendência natural de cada substância reagir com outra determinada substância.
É a necessidade de choque entre as moléculas dos diferentes reagentes, que se encontram em movimento desordenado. Nesse quesito, devemos considerar também que a orientação e o ângulo em que as moléculas se chocam é fator determinante para que a reação ocorra, assim como a energia com que estas moléculas se chocam, que deve ser no mínimo igual a energia de ativação do sistema em questão.
Para que uma reação ocorra, é necessário além dos outros requisitos como afinidade e orientação, que haja energia suficiente nesse sistema, para que as ligações dos reagentes se desfaçam, formando as novas ligações nos produtos. A essa energia denomina-se energia de ativação.
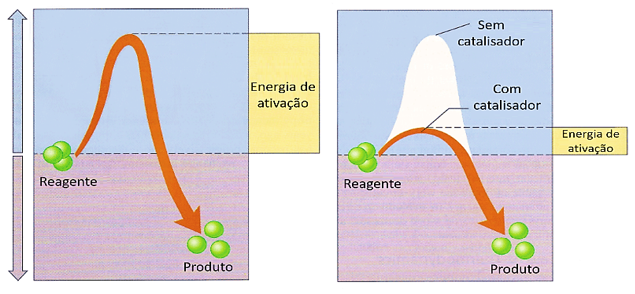
Além dos fatores intrínsecos aos reagentes, alguns fatores externos também influenciam na velocidade em que as reações se processam.
Os gases apresentam maior facilidade de locomoção do que as moléculas de um líquido ou sólido. Os sólidos ainda se apresentam mais agregados, e, portanto, com menor superfície de contato disponível.
Em se tratando de reagentes sólidos, temos que quanto maior a superfície de contato, maior a velocidade de reação, assim, pós macerados reagirão mais rapidamente do que blocos da mesma substância.
O aumento da temperatura aumenta a energia do sistema, e consequentemente, aumenta a probabilidade de choques entre os reagentes, aumentando assim a velocidade de ocorrência da reação. Segundo a regra de Van´t Hoff, um aumento de 10ºC na temperatura irá duplicar a velocidade de uma reação.

Pressão: numa reação entre reagentes gasosos, o aumento da pressão ocasiona diminuição do volume, e consequentemente, maior probabilidade de choque entre as moléculas reagentes, e assim, maior velocidade.
Algumas reações, para se iniciarem, precisam de uma fonte de energia que leve as moléculas a situação de complexo ativado. Essa energia pode ser obtida pela corrente elétrica, na forma de uma faísca, ou ainda na forma de luz, como a radiação ultravioleta.
São substâncias que entram num sistema reacional fazendo com que o complexo ativado seja formado em energias menores. Este não é consumido durante a reação, como também não altera a variação da entalpia (visto que só altera o estado ativado, mas não os estados iniciais e finais).
Quanto maior a concentração dos reagentes num sistema reacional, maior a probabilidade de choques efetivos entre as moléculas reagentes, e portant, aumenta a velocidade da reação. De forma geral, temos que dobrando a concentração de um dos reagentes, a velocidade também duplica. Já se dobrarmos as concentrações de dois reagentes, a velocidade se quadruplica.
A velocidade em relação as concentrações também pode ser obtida pela lei da velocidade. Considerando uma reação Aa +Bb →Cc +Dd, temos que a velocidade pode ser calculada por \(V=K{{[A]}^{a}}\cdot{{[B]}^{b}}\), onde [A] e [B] representam as concentrações dos reagentes e os expoentes a e b representam a ordem da reação em relação a esses reagentes (ou ordem geral, dada por a+b). Essa lei é válida quando a reação se processa em apenas uma etapa. Já em reações com mais de uma etapa, a velocidade da reação será determinada pela etapa mais lenta.
(UFC -CE) A Química Ambiental procura, entre outras coisas, adotar formas de atenuar a emissão de substâncias gasosas que depreciam a qualidade do ar. A reação entre os gases monóxido de carbono e oxigênio para produzir dióxido de carbono, de acordo com a equação abaixo, tem grande importância para o estudo ecológico:
\[2C{{O}_{(g)}}+{{O}_{2(g)\,}}\to\,2C{{O}_{2(g)}}\]
Considerando a reação simples, assinale a alternativa correta :
(FATEC - SP) A decomposição do acetaldeído, a 800 K, segundo a reação: \(C{{H}_{3}}CH{{O}_{(g)}}\,\to\,C{{H}_{4(g)}}\,C{{O}_{(g)}}\) ,iniciou-se com uma velocidade de \(1,8\cdot{{10}^{-16}}mol.{{\ell }^{-1}}.{{s}^{-1}}\).
O gráfico que representa a variação de velocidade de decomposição do acetaldeído em função do tempo será:
(UEL – PR) O ozônio próximo à superfície é um poluente muito perigoso, pois causa sérios problemas respiratórios e também ataca as plantações através da redução do processo da fotossíntese. Um possível mecanismo que explica a formação de ozônio nos grandes centros urbanos é através dos produtos da poluição causada pelos carros, representada pela equação química a seguir:
\[N{{O}_{2}}(g)+{{O}_{2}}(g)\,\to\,NO(g)+{{O}_{3}}(g)\]
Estudos experimentais mostram que essa reação ocorre em duas etapas:
I. \(N{{O}_{2}}(g)+\xrightarrow{Luz}\,NO(g)+O(lenta)\)
II. \({{O}_{2}}(g)+\to{{O}_{2}}(g)\,(lenta)\)
De acordo com as reações apresentadas, a lei da velocidade é dada por:
(UFMG - MG) Analise este gráfico, em que está representada a variação da concentração de um reagente em função do tempo em uma reação química:
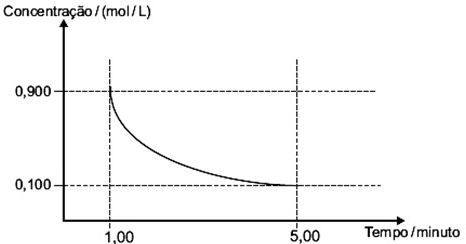
Considerando-se as informações desse gráfico, é CORRETO afirmar que, no intervalo entre 1 e 5 minutos, a velocidade média de consumo desse reagente é de:
(PUCCamp – SP) Para mostrar a diferença da rapidez da reação entre ferro e ácido clorídrico, foi utilizado o ferro em limalha e em barra. Pingando dez gotas de ácido clorídrico 1,0 \(mol.{{L}^{-1}}\) em cada material de ferro, espera-se que a reação seja
(PUC – SP) O fluoreto de nitrila \((N{{O}_{2}}F)\) é um composto explosivo que pode ser obtido a partir da reação do dióxido nitrogênio \((N{{O}_{2}})\) com gás flúor \([{{F}_{2}}]\), descrita pela equação.
\[2N{{O}_{2}}(g)+{{F}_{2(g)}}\,\to\,2N{{O}_{2}}{{F}_{(g)}}\]
A tabela a seguir sintetiza os dados experimentais obtidos de um estudo cinético da reação.
A expressão da equação da velocidade nas condições dos experimentos é
(UFPE – PE) Sobre os parâmetros e variáveis que governam a velocidade de reações químicas, podemos afirmar que:
(PUC – MG) Assinale a alternativa incorreta:
(UFMG – MG) A água oxigenada, , decompõe-se para formar água e oxigênio, de acordo com a equação:
\[{{H}_{2}}{{O}_{2}}_{(l)\,}\to\,{{H}_{2}}{{O}_{(l)}}+{\scriptstyle{}^{1}/{}_{2}}{{O}_{2(g)}}\]
A velocidade dessa reação pode ser determinada recolhendo-se o gás em um sistema fechado, de volume constante, e medindo-se a pressão do oxigênio formado em função do tempo de reação.
Em uma determinada experiência, realizada a 25 ºC, foram encontrados os resultados mostrados no gráfico.
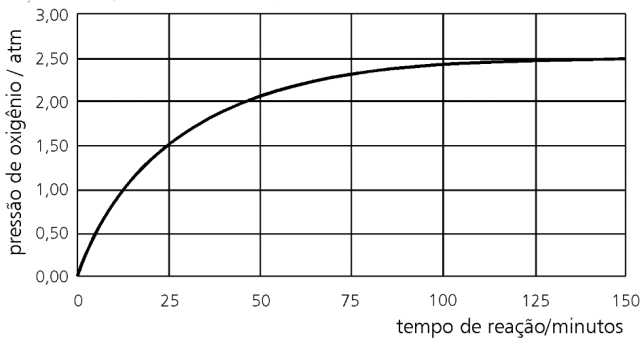
Considerando-se o gráfico, pode-se afirmar que a velocidade de decomposição da água oxigenada
(UEM – PR) Em um recipiente fechado e sob condições adequadas, a reação
\[{{A}_{2(g)}}+3{{B}_{2(g)}}\,\to\,2A{{B}_{3(g)}}\]
está se processando de modo a obedecer à equação da Lei de Velocidade \(v=k[{{A}_{2}}].{{[{{B}_{2}}]}^{3}}\). Diminuindo-se pela metade as concentrações de A e de B e permanecendo todas as demais condições constantes, observar-se-á que a velocidade da reação.
(UFTM – MG) A emissão do gás tóxico monóxido de carbono pode ser diminuída fazendo-se a sua combustão, o que o transforma no gás dióxido de carbono. Supondo-se que essa reação ocorra em uma única etapa e seja representada pela equação química
\[2C{{O}_{(g)}}+{{O}_{2(g)\,}}\to\,2C{{O}_{2(g)}}\]
pode-se afirmar, então, que:
(UEM – PR) Assinale o que for correto.
(UEM – PR) Os conversores catalíticos automotores, baseados em ligas metálicas sólidas contendo ródio, paládio ou molibdênio, são dispositivos antipoluição existentes na maioria dos carros. Sua função é absorver moléculas de gases poluentes e, através de um processo chamado catálise, oxidar ou decompor esses gases, como mostra o exemplo abaixo. Para a reação global \(2N{{O}_{(g)}}+{{O}_{2(g)\,}}\to\,2N{{O}_{2(g)}}\), na qual \(N{{O}_{2}}\) atmosférico é gerado a partir de NO expelido dos escapamentos de automóveis, é proposto o seguinte mecanismo, em duas etapas:
\(\begin{align} &{{N}_{2}}{{O}_{2(g)}}+{{O}_{2(g)\,}}\to \,2N{{O}_{2(g)\,}}(etapa\,\,lenta) \\ & 2NO(g)\,\to\,{{N}_{2}}{{O}_{2(g)}}\,(etapa\,\,r\acute{a}pida) \\ \end{align}\)
Considerando essas afirmações, assinale o que for correto.
(UEM – PR) Considerando os fundamentos da cinética das reações químicas, assinale o que for correto.
(UEM – PR) A uma dada temperatura, medidas experimentais da velocidade da reação abaixo mostraram tratar-se de uma reação de primeira ordem em relação à concentração de \({{S}_{2}}{{O}_{8}}^{2-}\) e também de primeira ordem em relação a \({{l}^{-}}\).
\[{{S}_{2}}{{O}_{8}}^{2-}+3{{l}^{-}}\,\to2S{{O}_{4}}^{2-}+{{l}_{3}}^{-}\]
Considerando essas afirmações, assinale a(s) alternativa(s) correta(s).
(UEM – PR) Assinale o que for correto.
(UEM – PR) Com base no perfil para as reações 1 e 2 descritas pelas curvas do gráfico abaixo, assinale o que for correto.
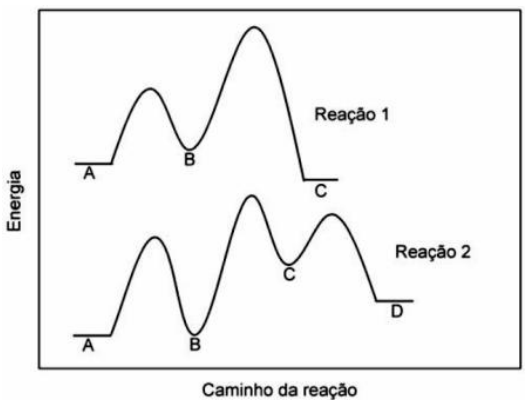
(UEM – PR) A reação na fase gasosa
\(2Cl{{O}_{2(g)}}+F\,\to\,2Fcl{{O}_{2(g)}}\) é de primeira ordem com relação a cada um dos reagentes (dados experimentais). A 250 K, a constante de velocidade da reação é de 1,2 L \(mo{{l}^{-1}}{{\min}^{-1}}\). Sendo assim, a ordem total da reação e a velocidade da reação, quando
\([Cl{{O}_{2}}]=0,02\,mol\,\,{{L}^{-1}}\) e \([{{F}_{2}}]=0,035\,mol\,\,{{L}^{-1}}\), nessas condições, serão, respectivamente,
(UEM – PR) Considerando o gráfico abaixo, que representa uma reação genérica na qual podem ser obtidos, simultaneamente, dois produtos diferentes, assinale o que for correto.
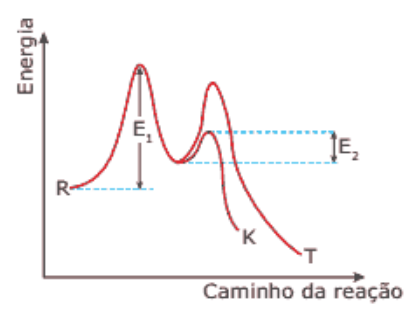
(ITA - SP) Considere que a decomposição \({{N}_{2}}{{O}_{5}}\), representada pela equação química global
\(2{{N}_{2}}{{O}_{5}}\,\to\,4N{{O}_{2}}+{{O}_{2}}\), apresente lei de velocidade de primeira ordem. No instante inicial da reação, a concentração de \({{N}_{2}}{{O}_{5}}\) é de 0,10 \(mol.{{L}^{-1}}\) e a velocidade de consumo desta espécie é de 0,022 \(mol\,.\,{{L}^{-1}}\,.\,\,{{\min}^{-1}}\). Assinale a opção que apresenta o valor da constante de velocidade da reação global, em \(\,{{\min}^{-1}}\).
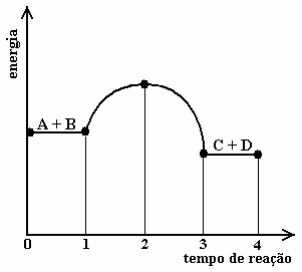
(UEM – PR) Considerando o gráfico abaixo, que é relacionado à reação \(A+B\Rightarrow\,C+D\), ocorrendo somente no sentido indicado e não havendo equilíbrio químico, assinale a alternativa incorreta.
(ITA – SP) Considere as seguintes afirmações relativas a reações químicas em que não haja variação de temperatura e pressão
I. Uma reação química realizada com a adição de um catalisador é denominada heterogênea se existir uma superfície de contato visível entre os reagentes e o catalisador.
II. A ordem de qualquer reação química em relação à concentração do catalisador é igual a zero.
III. A constante de equilíbrio de uma reação química realizada com a adição de um catalisador tem valor numérico maior do que a da reação não catalisada.
IV. A lei de velocidade de uma reação química realizada com a adição de um catalisador, mantidas constantes as concentrações dos demais reagentes, é igual àquela da mesma reação não catalisada.
V. Um dos produtos de uma ração química pode ser o catalisador desta mesma reação.
Das afirmações feitas, estão CORRETAS:
(UFMA – MA) A figura abaixo representa o diagrama de energia potencial para a reação de combustão do carbono, em forma de uma barra compactada.
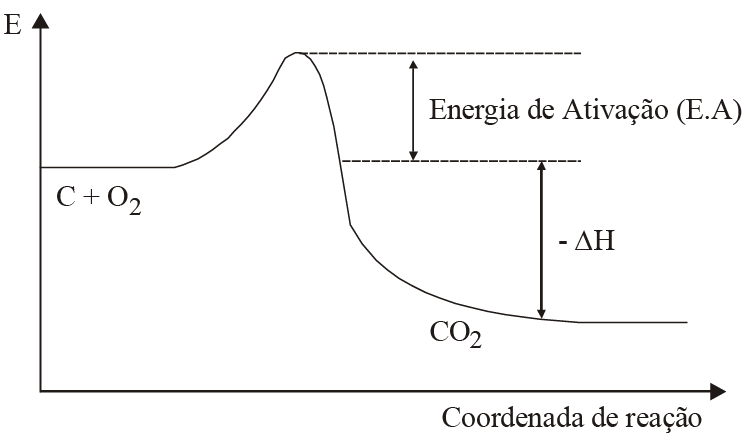
Admita agora que essa barra seja transformada em um pó muito fino e que a mesma reação de combustão seja efetuada.
Assim sendo, é verdadeiro afirmar que:
(PUC – SP) A reação \(2N{{O}_{(g)}}\,\,+2{{H}_{2(g)}}\,\to\,{{N}_{2(g)}}+2{{H}_{2}}{{O}_{(g)}}\) foi estudada a 904oC. Os dados da tabela seguinte referem-se a essa reação.
A respeito dessa reação é correto afirmar que sua expressão da velocidade é:
(UFPR – PR) A velocidade média da reação a A + b B → c C + d D pode ser definida pela expressão I, a seguir:
Expressão I:
Considere agora a reação de decomposição da água oxigenada.
\[Vm=-\frac{1}{a}\,\,\cdot\,\,\frac{\Delta [A]}{\Delta t}=-\frac{1}{b}\,\,\cdot \,\,\frac{\Delta[B]}{\Delta t}=-\frac{1}{c}\,\,\cdot \,\,\frac{\Delta [C]}{\Delta t}=-\frac{1}{d}\,\,\cdot \,\,\frac{\Delta [D]}{\Delta t}\,\]
\(2{{H}_{2}}{{O}_{2(g)}}\,\to\,2{{H}_{2}}{{O}_{(l\acute{i}q)}}+{{O}_{2(g)}}\)
A tabela ao lado fornece as concentrações, em mol por litro, da água oxigenada, em função do tempo da reação.
Com base nas informações acima, é correto afirmar:
(UFSC – SC) A sacarose sofre reação de hidrólise em meio aquoso produzindo glicose e frutose. O gráfico abaixo representa a variação da concentração de sacarose em função do tempo em dois valores diferentes de pH, à temperatura de 298 K. A equação simplificada para a reação pode ser escrita como:
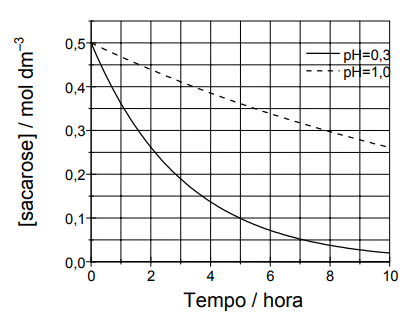
De acordo com as informações do enunciado e do gráfico acima, assinale a(s) proposição(ões) CORRETA(S).
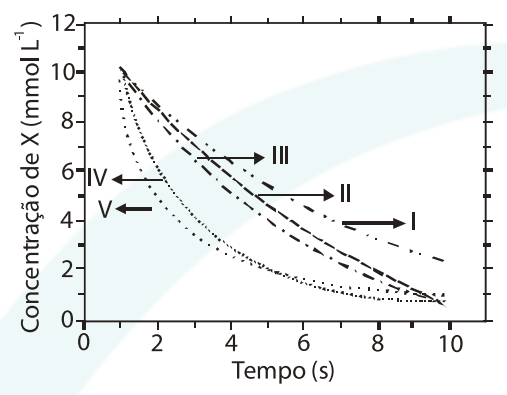
(ITA – SP) A figura apresenta cinco curvas (I, II, III, IV e V) da concentração de uma espécie X em função do tempo. Considerando uma reação química hipotética representada pela equação X(g) → Y(g) , assinale a opção CORRETA que indica a curva correspondente a uma reação química que obedece a uma lei de velocidade de segunda ordem em relação à espécie X.
(UEM – PR) Sobre a combustão completa do propano \(({{C}_{3}}{{H}_{8}})\), observou-se que 2,24 litros desse gás são consumidos em 10 minutos.
Considerando o sistema nas CNTP e que o propano, o \({{O}_{2}}\) e o \(C{{O}_{2}}\) são gases ideais, responda:
(ITA – SP) Existem reações que, apesar de termodinamicamente possíveis, ocorrem com velocidade tão pequena que pode levar dias para que sua ocorrência seja percebida, ao passo que outras ocorrem com velocidade tão grande que chegam a ser explosivas. Como, num laboratório de química, você procederia para:
(PUC – MG) Os conversores catalíticos, usados nos escapamentos dos automóveis, têm uma estrutura que sugere um grande favo de mel, com um número muito grande de buracos de forma hexagonal. Esses buracos são revestidos com material catalisador, e os gases provenientes da descarga circulam por esse favos antes de serem lançados na atmosfera. Explique o motivo pelo qual a estrutura acima descrita catalisa reações com mais eficiência do que um conversor catalítico na forma de um tubo, revestido com mesmo catalisador.
Você chegou ao fim dessa aula com sucesso!
Selecione o botão avançar para seguir para a próxima aula.