As reações que ocorrem com transferência de elétrons entre os pares reagentes, denomina-se oxirredução. Por exemplo, se mergulharmos uma lâmina de zinco (Zn) numa solução de sulfato de cobre \((CuS{{O}_{4}})\), que apresenta coloração azulada, percebe-se que na superfície da lâmina de Zn, ocorre a deposição de um sólido avermelhado, devido a formação de uma camada de Cu metálico, e a solução antes azulada fica incolor. O que acontece nesse caso, é que a solução de sulfato de cobre se dissocia em íons \(C{{u}^{2+}}\) e \(S{{O}_{4}}^{2-}\). Os cátions \(C{{u}^{2+}}\) migram até a lâmina de Zn e retiram elétrons desse, ficando neutros (Cu⁰), depositando-se sobre a lâmina. Os átomos de Zn que doam os elétrons, se transferem para a solução, na forma de cátions \(Z{{n}^{2+}}\). Reação de transferência de \(2{{e}^{-}}\):
\[Z{{n}^{0}}+C{{u}^{2+}}\,\to\,Z{{n}^{2+}}+C{{u}^{0}}\]
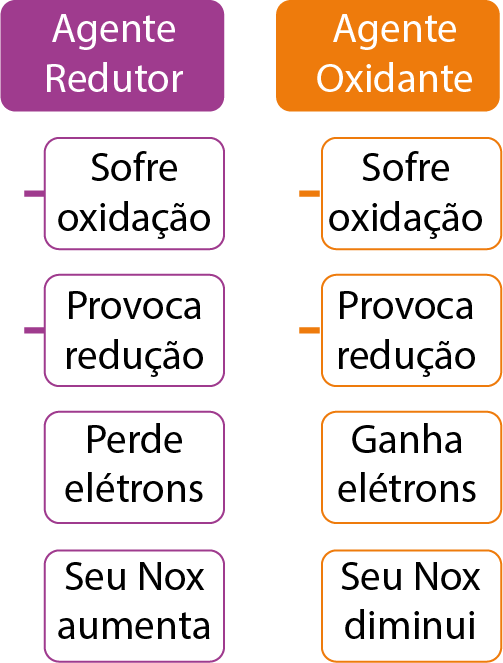
É a reação de perda de elétrons por uma espécie química. No exemplo, o Zn sofre oxidação.
\[Zn\xrightarrow{perda\,de\,2\,e\,el\acute{e}trons}Zn_{(aq)}^{2+}+2\,el\acute{e}trons\]
O elemento que sofre oxidação é responsável por ocasionar a redução da outra espécie, por isso é denominado agente redutor.
É a reação de ganho de elétrons por uma espécie química. No caso, o Cu sofre redução.
\[Cu_{(aq)}^{2+}+2\,el\acute{e}trons\xrightarrow{ganha\,2\,el\acute{e}trons}Cu\]
O elemento que sofre redução, que é o responsável por promover a oxidação do outro elemento, é nomeado agente oxidante.
As reações de oxidação e redução sempre ocorrem simultaneamente, envolvendo o mesmo número de elétrons.

É o número de representa a carga de uma espécie química.
Nas espécies iônicas, o nox pode ser obtido pela tendência de doar ou receber elétrons. Por exemplo, metais da família 1A e 2A tem respectivamente, nox +1 e +2. Já os não-metais da família 6A e 7A tem respectivamente, nox -2 e -1.
Nos compostos covalentes, o nox negativo deve ser atribuído a espécie mais eletronegativa e o nox positivo a espécie menos eletronegativa. Por exemplo, na molécula de água, o oxigênio é mais eletronegativo que o hidrogênio. O átomo de oxigênio compartilha elétrons com dois H, e os atrai com mais intensidade, sendo atribuído então o nox -2. Já cada átomo de H, compartilha um par de elétrons com o O, sendo assim, a cada um deles se atribui nox +1. Dessa forma, a soma dos nox de cada átomo da molécula resulta em zero.
Em casos de moléculas diatômicas, como o \({{O}_{2}}\), onde ambos os átomos têm a mesma eletronegatividade, a estes são atribuídos nox zero.
Nox e oxirredução: Nas reações de oxirredução, com perdas e ganhos de elétrons, as espécies envolvidas sofrerão alteração no nox.
Assim, temos: oxidação é o aumento do nox; redução é a diminuição do nox.
O balanceamento de reações de oxirredução viabiliza o equilíbrio entre os elétrons cedidos e recebidos, assim como entre as quantidades molares de cada elemento nos reagentes e produtos.
XXI. determinar o nox de todos os elementos participantes, tanto nos reagentes quanto nos produtos, e assim identificar os elementos que sofrem oxidação e redução.
XXII. determinar a variação total do nox (Δ) dos elementos que sofrem redução e oxidação, multiplicando o nox do elemento pelo maior índice apresentado (assim temos o número total de elétrons recebidos pelo agente oxidante e de elétrons perdidos pelo agente redutor).
XXIII. atribua como coeficiente do agente redutor, o Δ do oxidante, e vice-versa. Isso deve ser feito em apenas um dos membros, reagentes ou produtos, de preferência no membro com maior número de átomos que sofrem oxirredução, ou ainda, no membro com maior número de espécies.
XXIV. finalizar o balanceamento pelo método das tentativas.
(ITA – SP) Assinale a opção relativa aos números de oxidação CORRETOS do átomo de cloro nos compostos \(KCl{{O}_{2}},\,Ca{{(ClO)}_{2}},\,Mg{{(Cl{{O}_{3}})}_{2}}\) e \(Ba{{(Cl{{O}_{4}})}_{2}}\), respectivamente.
(ITA – SP) Considere as reações representadas pelas seguintes equações químicas balanceadas:
I. \(C{{H}_{4}}_{(g)}+{{H}_{2}}{{O}_{(g)}}\,\to\,C{{O}_{(g)}}+3{{h}_{2}}_{(g)}\)
II. \(AgC{{l}_{(c)}}+2N{{H}_{3(aq)\,}}\to\,Ag(N{{H}_{3}})_{2(aq)}^{+}+Cl_{(aq)}^{-}\)
III. \(Z{{n}_{(c)}}+2H_{(aq)}^{+}\,\to\,Zn_{(aq)}^{2+}+{{H}_{2(g)}}\)
IV. \(2H_{(aq)}^{+}+2CrO_{4(aq)}^{2-}\,\to\,C{{r}_{2}}O_{7(aq)}^{2-}+{{H}_{2}}{{O}_{(l)}}\)
Qual das opções abaixo se refere às reações de oxidorredução?
(UEM – PR) Os números de oxidação dos átomos Sb, Br, Ir, Fe, C e P, nos compostos \(S{{b}_{4}}{{O}_{10}},\,\,Br{{O}_{4}}^{-},\,\,l\,rc{{l}_{6}}^{-},\,N{{a}_{2}}F{{e}_{2}}{{O}_{4}},\,Ca{{C}_{2}}{{O}_{4}}\) e \(HP{{O}_{3}}^{2-}\), serão, respectivamente,
(UNESP – SP) O etilômetro (popular “bafômetro”) deverá ser muito utilizado pelos policiais para o controle do teor de álcool etílico ingerido pelos motoristas, de acordo com a Lei n.º 11.705 (chamada “Lei Seca”). Num dos tipos de “bafômetro”, a medida baseia-se na alteração da cor alaranjada para verde dos sais de cromo, decorrente da seguinte reação,
\(\begin{align} &3C{{H}_{3}}C{{H}_{2}}OH+2{{K}_{2}}C{{r}_{2}}{{O}_{7}}+8{{H}_{2}}S{{O}_{4}}\,\to\, \\ & \to\,3C{{H}_{3}}COOH+2C{{r}_{2}}{{(S{{O}_{4}})}_{3}}+2{{k}_{2}}S{{O}_{4}}+11{{H}_{2}}O\\ \end{align}\)
sobre a qual pode-se afirmar que:
(FATEC) A reação que ocorre entre a fosfina e o oxigênio é representada pela equação química
\[2P{{H}_{3(g)}}+4{{O}_{2(g)}}\,\to\,{{P}_{2}}{{O}_{5(g)}}+3{{H}_{2}}{{O}_{(g)}}\]
As substâncias que atuam como agente oxidante e agente redutor desse processo são, respectivamente,
(UECE) Atente para as seguintes afirmações:
I. Café, quando embalado a vácuo, tem uma vida útil mais longa, porque é mantido na ausência de oxigênio, que participa de grande parte das reações de decomposição dos alimentos, além de ser essencial para o metabolismo dos microrganismos responsáveis por essas degradações.
II. A vida útil do coco verde exportado para a Europa se prolonga até 60 dias se ele é revestido com uma fina camada de parafina, porque a parafina serve de “embalagem” impermeável ao oxigênio do ar e à umidade atmosférica, impedindo que as substâncias do coco passíveis de sofrer degradação entrem em contato com esses agentes.
III. Uma simples camada de pintura de “zarcão” (basicamente um óxido de chumbo) protege o ferro da corrosão, porque a película formada por esse óxido sobre o ferro impede o contato entre esse metal e o oxigênio e a umidade do ar, evitando sua corrosão.
É correto o que se afirma em
(FURG – RS) Nos sistemas biológicos, uma função importante de determinadas biomoléculas é o transporte de elétrons. Uma das mais importantes biomoléculas é a nicotinamida adenina dinucleotídeo (NAD) . A reação de oxidorredução que acontece na célula pode ser representada pelo seguinte equacionamento do equilíbrio: \(NA{{D}^{+}}+2{{e}^{-}}+{{H}^{+}}\,D\,\,NADH\). Sobre essa reação, assinale a alternativa correta.
(FEPECS – DF) O teor de ferro na hemoglobina pode ser determinado através da conversão de todo o ferro presente na amostra de sangue a \(F{{e}^{3+}}\), seguida de reação do material com permanganato, conforme pode ser observado na equação não-balanceada a seguir.
\[t\,{{H}^{+}}+u\,Mn{{O}^{4-}}+v\,F{{e}^{2+\,}}\to\,x\,F{{e}^{3+}}+y\,M{{n}^{2+}}+z\,{{H}_{2}}0\]
Após o balanceamento da equação com os menores coeficientes inteiros possíveis, os valores de t, u, v, x, y e z serão, respectivamente, iguais a:
(UFPI) Ajuste a seguinte equação química, cuja reação ocorre em meio ácido:
\[{{P}_{4(s)}}\,{{H}_{2}}O\,\to\,P{{H}_{3(g)}}\,+\,HP{{O}_{3}}{{^{-2}}_{(aq)}}+{{H}^{+}}\]
e assinale a afirmativa verdadeira:
(UEM - PR) Considere a reação química representada pela equação:
\[aMn{{O}_{2(s)}}+bHC{{l}_{(aq)\,}}\to\,cMnC{{l}_{2(aq)}}+d{{H}_{2}}{{O}_{(l)}}+eC{{l}_{2(g)}}\]
em que a, b, c, d e e são os coeficientes estequiométricos da equação química balanceada. Assinale a(s) alternativa(s) correta(s).
(UNICAMP) No Brasil, cerca de 12 milhões de pessoas sofrem de diabetes mellitus, uma doença causada pela incapacidade do corpo em produzir insulina ou em utilizá-la adequadamente. No teste eletrônico para determinar a concentração da glicose sanguínea, a glicose é transformada em ácido glucônico e o hexacianoferrato(III) é transformado em hexacianoferrato(II), conforme mostra o esquema a seguir.
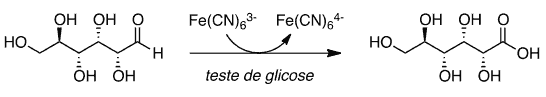
Em relação ao teste eletrônico, é correto afirmar que
(ITA – SP) Considere as equações químicas:
I. \({{F}_{2}}+{{H}_{2}}O\,\to \,2HF+{1}/{2}\;{{O}_{2}}\)
II. \(HCOOH\,\to{{H}_{2}}O+CO\)
III. \(C{{O}_{2}}+{{H}_{2}}\,\to\,{{H}_{2}}O+CO\)
IV. \(2{{H}_{2}}{{O}_{2}}\,\to\,2{{H}_{2}}O+{{O}_{2}}\)
V. \({{(N{{H}_{4}})}_{2}}C{{O}_{3}}\,\to\,2N{{H}_{3}}+{{H}_{2}}O+C{{O}_{2}}\)
As que não representam reações de oxidorredução são:
(USJT - SP) Nas substâncias \(CaC{{O}_{3}},\,Ca{{C}_{2}},\,C{{O}_{2}}\) (grafita) e \(C{{H}_{4}}\), os números de oxidação do carbono são, respectivamente:
(FUVEST – SP) A pólvora é o explosivo mais antigo conhecido pela humanidade. Consiste na mistura de nitrato de potássio, enxofre e carvão. Na explosão, ocorre uma reação de oxirredução, formando-se sulfato de potássio, dióxido de carbono e nitrogênio molecular.
Nessa transformação, o elemento que sofre maior variação de número de oxidação é o
(UFG – GO) A ferrugem é o oxido de ferro III, \(F{{e}_{2}}{{O}_{3}}\), resultante da oxidação do ferro metálico. Esta oxidação é catalisada pela umidade do ar.
A equação que representa a reação de oxidação do ferro é:
\[Fe+{{O}_{2}}\xrightarrow{{{H}_{2}}O}F{{e}_{2}}{{O}_{3}}\]
Sobre esta equação, é correto afirmar:
(UFPR - PR) Balancear uma equação química é determinar os valores dos seus coeficientes de modo a satisfazer certas condições. Considere a equação química não balanceada:
\[C{{r}_{2}}{{O}_{7}}^{2-}(aq)+F{{e}^{2+}}(aq)+{{H}^{+}}(aq)\,\to\,C{{r}^{3+}}(aq)+F{{e}^{3+}}(aq)+{{H}_{2}}O(liq)\]
Com base no exposto, é correto afirmar que a equação acima, quando balanceada, deve satisfazer as condições:
(UFRGS) Assinale com V (verdadeiro) ou F (falso) as afirmações abaixo, referentes a compostos inorgânicos.
( ) A sílica, presente na areia, e o gás carbônico fazem parte da mesma função inorgânica: os óxidos.
( ) O número de oxidação do oxigênio, no composto \(O{{F}_{2}}\), é -2.
( ) O óxido de alumínio pode comportar-se como óxido ácido ou como óxido básico.
A sequência correta de preenchimento dos parênteses, de cima para baixo, é
(UEM – PR) Considerando a reação \(aS+b{{O}_{2}}+c{{H}_{2}}0\,\,\Rightarrow\,d{{H}_{2}}S{{O}_{4}}\), assinale o que for correto.
(UEM – PR) Assinale o que for correto.
(UEM – PR) Dadas as equações químicas abaixo, não balanceadas, assinale o que for correto.
I) \(aKMn{{O}_{4}}+bFeS{{O}_{4}}+c{{H}_{2}}S{{O}_{4}}\\ \to\,d{{K}_{2}}S{{O}_{4}}+fF{{\text{e}}_{\text{2}}}{{\text{(S}{{\text{O}}_{\text{4}}}\text{)}}_{\text{3}}}\text{+g}{{\text{H}}_{\text{2}}}\text{O}\)
II) \(a{{K}_{2}}C{{r}_{2}}{{O}_{7}}+bN{{A}_{2}}{{C}_{2}}{{O}_{4}}+c{{H}_{2}}S{{O}_{4}}\\ \to\,d{{K}_{2}}S{{O}_{4}}+eCr{{(S{{O}_{4}})}_{3}}+fN{{a}_{2}}S{{O}_{4}}+g{{H}_{2}}O+hC{{O}_{2}}\)
(UEPG – PR) Sobre a equação abaixo, que representa a formação da ferrugem, assinale o que for correto.
\[4Fe+3{{O}_{2}}\,\to\,2F{{e}_{2}}{{O}_{3}}\]
(UFG – GO) A respeito da equação \(Mn{{O}_{2}}+HCl\,\to\,MnC{{l}_{2}}+{{H}_{2}}O+Cl\) estão corretas as frases:
(UFBA – BA) Considere-se a equação química não balanceada representada a seguir:
\[MnO_{4(aq)}^{-}+{{H}_{2}}{{O}_{2(aq)}}+H_{(aq)}^{+}\to\,Mn_{(aq)}^{2+}+{{H}_{2}}{{O}_{(\lambda )}}+{{O}_{2(g)}}\]
Com base nos conhecimentos sobre reações químicas, funções inorgânicas e fases da matéria e considerando-se a equação acima, balanceada com os menores coeficientes estequiométricos inteiros, pode-se afirmar:
(UNESP – SP) Dos extensos efeitos nocivos que a radiação ionização provoca na matéria viva, afigura-se a geração de radicais livres, que são espécies químicas eletricamente neutras que apresentam um ou mais elétrons desemparelhados na camada de valência. O íon cloreto, por exemplo, que, quantitativamente, constitui o principal ânion do plasma, transforma-se no radical livre Cl●, com 7 elétrons na camada de valência, podendo, assim, reagir facilmente com as biomoléculas, alterando o comportamento bioquímico de muitas proteínas solúveis do meio sanguíneo e também os constituintes membrenários de célula: hemácia, leucócitos, plaquetas.
Ao transformar-se em radical livre, o ânion cloreto
(ITA – SP) Ao misturar solução aquosa de bromato de sódio com solução aquosa ácida de iodeto de potássio ocorre uma reação representada pela equação não balanceada:
\[1Br{{O}_{3}}^{-}+x{{l}^{-}}+y{{H}^{+}}\,\to\,1B{{r}^{-}}+z{{l}_{2}}+w{{H}_{2}}O\]
O balanceamento desta equação pode ser feito pelo método das variações dos números de oxidação. Assinale a opção que contém essas variações para cada átomo e os coeficientes que balanceiam a equação.
(UNIP – SP) A soma dos coeficientes menores e inteiros para a equação abaixo é: \(KMn{{O}_{4}}+HBr\,\to\,KBr+MnB{{r}_{2}}+{{H}_{2}}O+B{{r}_{2}}\)
(UFPA – PA) Os coeficientes da equação \(M{{n}^{2+}}+Bi{{O}_{3}}^{-}+{{H}^{+}}\,\to\,Mn{{O}_{4}}^{-}+B{{i}^{3+}}+{{H}_{2}}O\)O são:
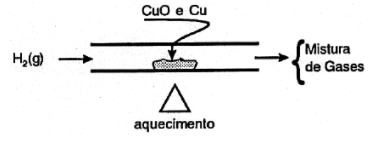
(UNICAMP – SP) O óxido de cobre-II, CuO, é reduzido pelo \({{H}_{2(g)}}\) a cobre metálico, em uma aparelhagem esquematizada abaixo:
(UNESP – SP) O peróxido de hidrogênio \(({{H}_{2}}{{O}_{2}})\) pode participar de reações de oxidorredução como oxidante ou como redutor. Por exemplo, em meio ácido, íons dicromato \((C{{r}_{2}}O_{T}^{1-})\) são reduzidos a íons crômico \((C{{r}^{3+}})\) pelo peróxido de hidrogênio, conforme a reação representada pela equação:
\[C{{r}_{2}}O_{7(aq)}^{2-}+3{{H}_{2}}{{O}_{2(l)}}+8{{H}^{+}}_{(aq)}\,\to\,\,2C{{r}^{3+}}_{(aq)}+3{{O}_{2(g)}}+7{{H}_{2}}{{O}_{(l)}}\]
(UFRJ - RJ) A análise da água de uma lagoa revelou a existência de duas camadas com composições químicas diferentes, como mostra o desenho a seguir.
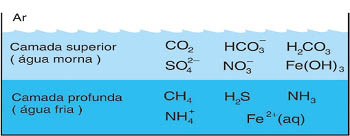
20) (UFRJ - RJ) A análise da água de uma lagoa revelou a existência de duas camadas com composições químicas diferentes, como mostra o desenho a seguir.
Você chegou ao fim dessa aula com sucesso!
Selecione o botão avançar para seguir para a próxima aula.